 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Термохимия. Закон Гесса. Стандартные теплоты образования и сгорания. Уравнения Кирхгоффа
|
|
При химических реакциях происходит изменение внутренней энергии системы, т.к. внутренняя энергия продуктов реакции отличается от внутренней энергии исходных веществ. Изучение изменений U при химических реакциях является одним из основных путей изучения энергии химических связей. Кроме того, изменения U при реакции (или теплота реакции) являются необходимыми исходными величинами для термодинамических расчетов химических реакций, имеющих большое практическое значение для химической технологии.
Изменение U в процессе химического превращения вещества происходит, как и в др. случаях, путем поглощения (выделения) теплоты и совершения работы. Работа обычно мала; она может быть вычислена или ею можно пренебречь. Теплота реакции часто значительна; она может быть во многих случаях непосредственно измерена. Изучением теплот химических реакций занимается термохимия.
Закон: Количество теплоты, необходимое для разложения соединения на его составные части, равно количеству теплоты, выделяющейся при образовании соединения из тех же составных частей.
Изменение U при химической реакции, в соответствии с I законом термодинамики, не зависит от пути, по которому протекает реакция, а лишь от химической природы и состояния начальных и конечных веществ реакции. Теплота реакции в общем случае не является изменением функции состояния и зависит от пути процесса. Однако по крайней мере в двух простейших случаях теплота процесса не зависит от его пути:
1. Реакция протекает при V = const и не совершается электрическая и др. виды работы: QV = DU = U2 - U1
2. Реакция протекает при P = const и совершается только работа объемного расширения: QP = DH = H2 - H1
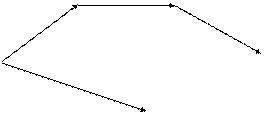
Закон независимости суммарной теплоты химической реакции от пути процесса был открыт в 1836 г. (еще до установления I ЗТ) русским ученым Гессом. Закон Гесса (закон постоянства сумм теплот реакций) -основной закон термохимии: если из данных исходных веществ можно получить заданные конечные продукты разными путями, то суммарная теплота процесса на каком-либо одном пути равна суммарной теплоте процесса на любом другом пути, т.е. не зависит от пути перехода от исходных веществ к продуктам реакции. Закон Гесса вытекает из I ЗТ при ограничивающих условиях: V = const или P = const. Схематически это можно показать следующим образом:
Q1 + Q2 + Q3 = Q4 + Q5 | CQ2 D
 Q3
Q1
A B
Q4 Q5
E Q3
Q1
A B
Q4 Q5
E
|
В термодинамике: Q > 0 - которое подводится к системе и ею поглощается, Q < 0 - которое система выделяет; в термохимии: Q > 0 - которое выделяется (экзотермическая реакция), Q < 0 - которое поглощается (эндотермическая реакция). QP, QV - термодинамические обозначения;  ,
,  - термохимические.
- термохимические.
QP = -  , QV = -
, QV = -  ; QP = DHo298, QV = DUo298
; QP = DHo298, QV = DUo298
В обоих случаях: А > 0, если производится системой; А < 0, если внешние силы совершают работу над системой. Расширение > 0, сжатие < 0.
Соответственно, существуют две системы записи уравнений химической реакции с учетом теплового эффекта:
1. Термохимическое уравнение:
С6Н6 (ж) + 7 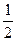 О2 = 6СО2 + 3Н2О (ж) + 780980 кал
О2 = 6СО2 + 3Н2О (ж) + 780980 кал
Значки в скобках указывают на агрегатное состояние компонента; эти символы опускают, когда при условиях проведения реакции агрегатное состояние компонента реакции является вполне определенным.
2. В настоящее время более принята термодинамическая система записи теплот химических реакций:
С6Н6 (ж) + 7 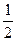 О2 = 6СО2 + 3Н2О (ж); DHo298 = - 780980 кал
О2 = 6СО2 + 3Н2О (ж); DHo298 = - 780980 кал
Если в реакции участвуют только твердые и жидкие вещества, то изменение объема DV незначительно и QP» QV. Если же в реакции участвуют газообразные вещества при небольших Р, то связанное с этим изменение объема при постоянных Р и Т значительно.
PDV = P (V2 - V1) = PV2 - PV1 = n2RT - n1RT = DnRT
QP = QV + DnRT,  =
=  - DnRT
- DnRT
Здесь Dn - разность между числом молей газообразных продуктов реакции и газообразных исходных веществ.
Значение закона Гесса заключается в том, что, пользуясь им, можно определить теплоты реакций, которые или не реализуются на практике, или не могут быть проведены чисто и до конца. Пример:
1. С + О2 = СО2 QP1 3. СО + 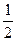 О2 = СО2 QP3
О2 = СО2 QP3
2. С + 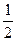 О2 = СО QP2
О2 = СО QP2
QP2 опытным путем определить невозможно, но можно найти с помощью закона Гесса: QP1 = QP2 + QP3, необходимо только сравнивать теплоты различных реакций в одних и тех же условиях.
Дата публикования: 2015-11-01; Прочитано: 395 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!

