 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теплота изотермического процесса равна работе процесса
|
|
Закон Гей-Люссака–Джоуля: Внутренняя энергия идеального газа не зависит от давления и объема, а зависит только от температуры.
АДИАБАТИЧЕСКИЙ ПРОЦЕСС (dQ = 0, Q = 0)
Это процесс, протекающий без теплообмена между системой и окружающей средой.
PdV + CV dT = 0
 dV + CV dT = 0 /: T
dV + CV dT = 0 /: T
R  + CV
+ CV  = 0
= 0
R = CP - CV Þ (CP - CV)  + CV
+ CV  = 0 /: CV
= 0 /: CV
( - 1)
- 1)  +
+  = 0,
= 0,  = g
= g
После интегрирования: ln Vg-1 + ln T = const
ln TVg-1 = const
TVg-1 = const¢ (1)
T = 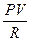 ,
, 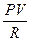 Vg-1 = const¢
Vg-1 = const¢
PVg = const¢¢ (2)
Уравнения (1) и (2) - уравнения адиабаты (уравнения Пуассона).
Работа при адиабатическом процессе:
dA + CV dT = 0, dA = - CV dT, A = -  = CV (T1 - T2)
= CV (T1 - T2)
A > 0 при расширении Þ Т падает при адиабатическом расширении, т.е. работа адиабатического расширения совершается за счет уменьшения внутренней энергии. При адиабатическом сжатии U увеличивается, Т растет.
A = CV (T1 - T2) = CV (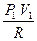 -
-  ) =
) =  (P1V1 - P2V2)
(P1V1 - P2V2)
A = 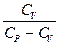 (P1V1 - P2V2) =
(P1V1 - P2V2) =  (P1V1 - P2V2) =
(P1V1 - P2V2) =  (P1V1 - P2V2)
(P1V1 - P2V2)
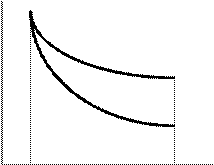 P
изотерма
адиабата
V1 V2 V P
изотерма
адиабата
V1 V2 V
|
Сравним: PVg = const¢¢ (адиабата) и PV = const (изотерма):
P = 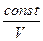 и P = и P = 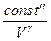 Адиабата идет круче, чем изотерма.
Адиабата идет круче, чем изотерма.
|
ЭНТАЛЬПИЯ (Теплосодержание).
Энтальпия Н - это сумма внутренней энергии (U) и внешней (PV):
H = U + PV
Если процесс идет при P = const:
dQP = dU + PdV = dU + d (PV) = d (U + PV) = dH
Тепло, передаваемое системе при P = const, расходуется на приращение энтальпии.
DH = DU + PDV
Изменение энтальпии в изобарном процессе включает в себя изменение внутренней и внешней энергии, причем изменение внешней энергии равно работе изобарного расширения (сжатия). U - функция состояния; Р и V - параметры состояния, их изменение не зависит от пути процесса. Следовательно, Н - также функция состояния, т.к. ее изменение не зависит от пути процесса.
dQP = dH, QP = DH
Теплота, поглощаемая при Р = const, также не зависит от пути процесса.
Если процесс изобарно-изотермический, то DU = 0 и DH = PDV.
СР =  =
=  , dH = CP dT, DH = CP DT
, dH = CP dT, DH = CP DT
Введение энтальпии упрощает математическое выражение изобарного процесса. Кроме того, изменение Н может быть во многих случаях легко измерено, вследствие чего эта функция широко применяется при термодинамических исследованиях, особенно изобарных процессов.
Абсолютное значение энтальпии не может быть вычислено с помощью уравнений термодинамики, т.к. оно включает в себя абсолютную величину внутренней энергии.
Лекция 3
Дата публикования: 2015-11-01; Прочитано: 375 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
