 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Неравенство Клаузиуса
|
|
Совместное применение первой и второй теорем Карно позволяет получить следующее неравенство:
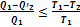
Знак равенства в этой формуле соответствует случаю описания обратимой тепловой машины, а знак меньше - описанию необратимой тепловой машины.
Формулу можно преобразовать к виду 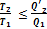
Это выражение в свою очередь дает 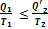 или
или 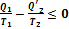
Если полученное выражение записать через количество теплоты, подводимой к рабочему телу от нагревателя 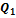 и холодильника
и холодильника 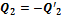 , то оно примет окончательную форму
, то оно примет окончательную форму 
Эта формула представляет собой частный случай неравенства Клаузиуса.
 Для получения неравенства Клаузиуса в общем случае рассмотрим тепловую машину, рабочее тело которой при совершении кругового термодинамического процесса обменивается теплотой с достаточно большим числом тепловых резервуаров (нагревателей и холодильников), имеющих температуры
Для получения неравенства Клаузиуса в общем случае рассмотрим тепловую машину, рабочее тело которой при совершении кругового термодинамического процесса обменивается теплотой с достаточно большим числом тепловых резервуаров (нагревателей и холодильников), имеющих температуры 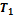 ,
, 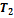 ,...,
,..., 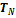 (см. рис). При этих теплообменах рабочее тело получает от тепловых резервуаров теплоты
(см. рис). При этих теплообменах рабочее тело получает от тепловых резервуаров теплоты 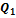 ,
, 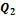 ,...,
,..., 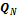 . Работа такой тепловой машины будет равна:
. Работа такой тепловой машины будет равна: 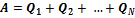 . При использовании этого выражения необходимо учитывать, что теплоты
. При использовании этого выражения необходимо учитывать, что теплоты 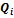 могут иметь отрицательный знак в случае, если в при теплообмене с -тым резервуаром теплота отбирается от рабочего тела.
могут иметь отрицательный знак в случае, если в при теплообмене с -тым резервуаром теплота отбирается от рабочего тела.
Схема тепловой машины с большим числом нагревателей и холодильников
Применительно к рассматриваемой тепловой машине неравенство может быть записано в виде
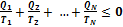 или
или 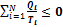
Величина  называется приведенным количеством теплоты, которое численно равно количеству теплоты, полученной системой, при абсолютной температуре
называется приведенным количеством теплоты, которое численно равно количеству теплоты, полученной системой, при абсолютной температуре 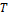 , деленной на эту температуру.
, деленной на эту температуру.
При переходе к бесконечному числу тепловых резервуаров, с которыми рабочее тело тепловой машины обменивается теплотой, суммирование в формуле может быть заменено интегрированием по замкнутому термодинамическому циклу: 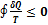
Из этой формулы следует, что сумма приведенных количеств теплоты на замкнутом цикле для любой термодинамической системы не может быть больше нуля. Неравенство было получено в 1862 году Клаузиусом и носит его имя.
Неравенство Клаузиуса позволяет отличать обратимые и необратимые круговые термодинамические процессы. В случае, если термодинамический цикл состоит только из обратимых процессов, неравенство переходит в равенство Клаузиуса  , имеющее принципиальное значение для построения равновесной термодинамики.
, имеющее принципиальное значение для построения равновесной термодинамики.
Случай строгого неравенства в формуле соответствует описанию необратимых круговых термодинамических процессов, и это выражение применяется в неравновесной термодинамике.
Статистическое толкование закона возрастания энтропии.
Рассматривая Вселенную как изолированную систему и распространяя на неё второй закон термодинамики, Р. Клаузиус пришёл к выводу о неизбежности «тепловой смерти» Вселенной, при которой в необозримом будущем в ней будет достигнуто состояние термодинамического равновесия и всякие процессы прекратятся. Этот вывод вызвал много споров, которые не прекращаются до сих пор. К Вселенной в целом как изолированной системе (F = 0) второе начало термодинамики неприменимо по определению. В силу этого предсказанная Р. Клаузиусом «тепловая смерть» вследствие непрерывного возрастания энтропии ей не угрожает. Понятие энтропии приложимо исключительно к открытым (неизолированным) термодинамическим системам.
Напомним, что ни классическая, ни современная термодинамика не отрицают применимости второго начала к изолированным системам и в силу этого принципиально не могут противостоять упомянутому выше утверждению Клаузиуса достаточно решительно. Они опираются на статистическое истолкование второго закона с помощью формулы Больцмана: S = k ln W, W – число способов, которым может быть реализовано данное конкретное состояние (число возможных расположений частиц в теле). При этом второй закон термодинамики формулируется следующим образом: природа стремится от состояния менее вероятного к состоянию более вероятному.
Связь между S и W позволяет несколько иначе сформулировать второе начало термодинамики: наиболее вероятным изменением энтропии является ее возрастание.
Энтропия – вероятностная статистическая величина. Утверждение о возрастании энтропии потеряло свою категоричность. Её увеличение вероятно, но не исключаются флуктуации*.
Поскольку все реальные процессы необратимы, то в случае их прохождения в изолированной системе ее энтропия всегда будет увеличиваться.
Принцип возрастания энтропии имеет большое практическое значение:
1. Он указывает на направление протекания процессов. Самопроизвольные процессы, приводящие систему к равновесному состоянию, идут в направлении возрастания энтропии системы. Следовательно, если система находится в неравновесном состоянии, то ее энтропия возрастает ΔSС>0.
2. Дает возможность судить о глубине самопроизвольных процессов. Такие процессы идут до достижения максимума энтропии системы SС=SСМАХ. Следовательно, если система находится в равновесном состоянии, то ее энтропия не изменяется ΔSС=0. Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния.
3. Увеличение энтропии системы может служить мерой необратимости протекающих в ней процессов, т.е. второй закон термодинамики дает не только качественную, но и количественную оценку процессов.
Таким образом, являясь статистическим законом, второй закон классической термодинамики выражает закономерности хаотического движения большого числа частиц, входящих в состав изолированной системы. Для систем с относительно малымили бесконечнымчислом частиц второй закон термодинамики неприменим: в первом случае из-за возможных значительных флуктуаций, во втором — из-за равновероятности всех микросостояний
* Флуктуа́ция (от лат. fluctuatio — колебание) — термин, характеризующий любое колебание или любое периодическое изменение.
49. Объединенный закон термодинамики.
В природе одновременно действуют две тенденции - стремление к минимуму энергии, и стремление к максимуму хаоса, т.е. одновременно действуют первый и второй законы термодинамики. И чтобы описать результат их совместного действия, нужны критерии, учитывающие сразу обе тенденции. Иными словами, нужно объединить первое и второе начала термодинамики.
 Рассмотрим круговой процесс, у которого процесс 1-а-2 протекает необратимо, а процесс 2-b-1 - обратимо. Представим круговой интеграл в виде суммы двух линейных интегралов с учетом
Рассмотрим круговой процесс, у которого процесс 1-а-2 протекает необратимо, а процесс 2-b-1 - обратимо. Представим круговой интеграл в виде суммы двух линейных интегралов с учетом 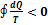 .
.
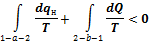
Второй интеграл равен разности энтропий  , тогда можно написать
, тогда можно написать 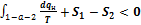 , или
, или 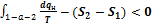 . Таким образом,
. Таким образом, 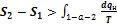 . Чем выше степень необратимости, тем больше разность между
. Чем выше степень необратимости, тем больше разность между 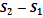 и
и 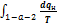 .
.
Представим 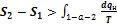 в дифференциальной форме
в дифференциальной форме 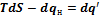 , где
, где  по Клаузиусу - нескомпенсированная теплота превращения. Используя дифференциальную форму, можно написать
по Клаузиусу - нескомпенсированная теплота превращения. Используя дифференциальную форму, можно написать
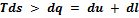 , откуда
, откуда 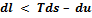 , т.е. работа, совершенная системой в необратимом процессе, меньше, чем при обратимом.
, т.е. работа, совершенная системой в необратимом процессе, меньше, чем при обратимом.
В общем случае объединенный закон термодинамик и можно представить в виде 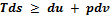 , где знак равенства относится к обратимым, а знак неравенства - к необратимым процессам.
, где знак равенства относится к обратимым, а знак неравенства - к необратимым процессам.
Однако эти неравенства не позволяют количественно определить влияние необратимости на эффективность ТС. Поэтому вернемся к уравнению 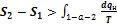 и перепишем его в виде
и перепишем его в виде 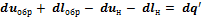
Так как оба процесса характеризуются одинаковыми состояниями в точках 1 и 2, то 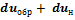 , тогда
, тогда 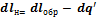 . Следовательно, теперь объединенный закон термодинамики примет вид
. Следовательно, теперь объединенный закон термодинамики примет вид 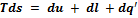 .
.
 Для обратимых процессов.
Для обратимых процессов. 
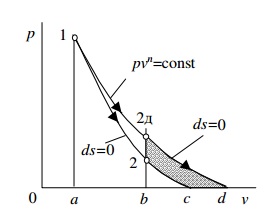
Применим 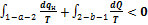 к примеру, показанному на рис.
к примеру, показанному на рис. 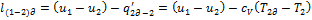 , то есть чтобы вернуть ТС из состояния, определяемого точкой 2д в состояние 2, необходимо от ТС отвести теплоту
, то есть чтобы вернуть ТС из состояния, определяемого точкой 2д в состояние 2, необходимо от ТС отвести теплоту 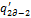 , при этом идеальная работа расширения также уменьшится на
, при этом идеальная работа расширения также уменьшится на 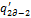
Для адиабатической системы (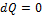 ) из
) из 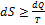 получим
получим 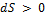 .
.
Это условие показывает, что если в адиабатической системе протекают любые обратимые процессы, то энтропия системы остается неизменной (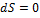 ). Протекание реальных процессов, которые всегда необратимы, сопровождается увеличением энтропии системы (
). Протекание реальных процессов, которые всегда необратимы, сопровождается увеличением энтропии системы ( ), то есть ТС переходит только в такое состояние, при котором
), то есть ТС переходит только в такое состояние, при котором 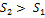 .
.
Отметим, что большинство энергетических машин и установок, в которых имеет место незначительный теплообмен с окружающей средой, можно мысленно заключить в адиабатическую оболочку и рассматривать их как открытые адиабатические термодинамические системы. Такое допущение существенно упрощает термодинамический анализ реальных систем.
50. Реальный газ. Уравнение Ван – дер – Ваальса.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона: 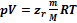 , где p — давление; V — объем; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.
, где p — давление; V — объем; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия U становится функцией не только температуры, но и объёма.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием.
Учитывая собственный объем молекул и силы межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальс (1837—1923) вывел уравнение состояния реального газа. Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не V m, а V m — b, где b — объем,занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е. 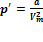 , где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения,
, где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, 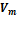 — молярный объем.
— молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов): 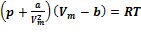
Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид 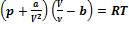 , или
, или 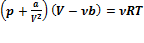 , где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
, где поправки а и b — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Дата публикования: 2015-11-01; Прочитано: 3281 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
