 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Второе начало термодинамики
|
|
Любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии).
Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие — нет.
Существуют ещѐ две формулировки второго начала термодинамики, эквивалентных закону возрастания энтропии:
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиус:. невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к телу более нагретому.
Процесс называетс я обратимым, если тело совершает в начале прямой процесс, а затем обратный, возвращаясь в первоначальное положение без изменений в окружающей среде. Энтропия остаётся постоянной в замкнутой системе только при обратимых процессах.
Процесс называется необратимым, если при протекании прямого и обратного процесса газ возвращается в первоначальное состояние, вызывая изменения в окружающей среде. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
В зависимости от условий переход термодинамической системы из равновесного состояния 1 в другое равновесное состояние 2 может быть либо обратимым, либо необратимым. При обратимом переходе все процессы в системе происходят очень медленно, а все промежуточные состояния, через которые проходит система, являются равновесными. Если параметры, управляющие обратимым переходом, изменять в обратном порядке, то система вернется из конечного состояния 2 в свое начальное состояние 1, снова пройдя через все прежние промежуточные состояния, но в обратном порядке. Причем во внешней среде не произойдет никаких изменений, и она также вернется в исходное состояние.
Строго говоря, обратимые процессы есть идеализация, к которой можно подойти сколь угодно близко, если нарушения механического и теплового равновесия бесконечно малы и отсутствуют диссипативные процессы с участием сил трения. Опыт показывает, что все реальные макроскопические процессы в то или иной степени необратимы. Примером необратимого процесса может служить расширение газа в пустоту через отверстие в стенке сосуда. Чтобы собрать вышедший газ в сосуд, необходимо совершить определенную работу за счет некоторого источника энергии, т.е. произвести определенные изменения в окружающей среде. Такие процессы в окружающей среде называются компенсационными.
Тепловой машиной называетсяустройство, которое преобразует теплоту в работу или обратно и действует строго периодически, т. е. после завершения цикла возвращается в исходное состояние.
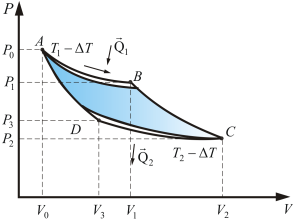
 Тепловая машина состоит из нагревателя, рабочего тела и охладителя рабочего тела. Охладителем, в конечном счете, служит окружающая среда. Тепловая машина работает по принципу замкнутого цикла, совершая круговой процесс. В ходе прямого цикла рабочее тело, например, пар, получив от нагревателя количество тепла Q1, расширяется от объема V1 до объема V3. Согласно первому закону термодинамики, это тепло расходуется на нагревание рабочего тела и на совершение механической работы
Тепловая машина состоит из нагревателя, рабочего тела и охладителя рабочего тела. Охладителем, в конечном счете, служит окружающая среда. Тепловая машина работает по принципу замкнутого цикла, совершая круговой процесс. В ходе прямого цикла рабочее тело, например, пар, получив от нагревателя количество тепла Q1, расширяется от объема V1 до объема V3. Согласно первому закону термодинамики, это тепло расходуется на нагревание рабочего тела и на совершение механической работы
Q1 = E2 ‑ E1 + A13, (2.52)
где E2 ‑ E1 — изменение внутренней энергии рабочего тела при переходе из состояния 1 в состояние 3. При обратном цикле над газом производится работа: газ сжимается и передает охладителю количество тепла Q2 = E1 ‑ E2 + A31. (2.53)
Складывая оба уравнения, получим Q1 ‑ Q2 = A13 + A31 = A, где А — полная работа, совершенная машиной за один цикл.
Отношение полезной работы, совершенной машиной, к количеству полученного тепла составляет КПД тепловой машины: 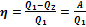 . (2.54)
. (2.54)
Понятно, что КПД машины всегда меньше единицы, поскольку не все количество полученного тепла переходит в полезную работу.
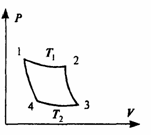
В реальных тепловых машинах КПД, очевидно, еще меньше, так как часть тепла теряется безвозвратно в процессе работы машины. Для получения максимального КПД следует рассмотреть рабочий цикл, образованный обратимыми процессами. Этому требованию отвечает цикл (см. рис.), впервые рассмотренный французским ученым Карно.
В качестве рабочего тела в цикле Карно рассматривается идеальный газ. Цикл Карно состоит из последовательных расширения и сжатия газа; причем каждый из процессов совершается сначала изотермически, а затем адиабатически. При прямом цикле тело по-прежнему сначала получает тепло, а затем отдает его. Достоинство цикла Карно состоит в том, что все процессы обратимы, и, следовательно, КПД такой машины будет максимальным.
46. КПД цикла Карно.
46. 
47.
КПД машины всегда меньше единицы, поскольку не все количество полученного тепла переходит в полезную работу.
В реальных тепловых машинах КПД, очевидно, еще меньше, так как часть тепла теряется безвозвратно в процессе работы машины. Для получения максимального КПД следует рассмотреть рабочий цикл, образованный обратимыми процессами. Этому требованию отвечает цикл (см. рис.), впервые рассмотренный французским ученым Карно.
В качестве рабочего тела в цикле Карно рассматривается идеальный газ. Цикл Карно состоит из последовательных расширения и сжатия газа; причем каждый из процессов совершается сначала изотермически, а затем адиабатически. При прямом цикле тело по-прежнему сначала получает тепло, а затем отдает его. Достоинство цикла Карно состоит в том, что все процессы обратимы, и, следовательно, КПД такой машины будет максимальным.
Пусть газ расширяется изотермически, переходя из состояния 1 в состояние 2. При изотермическом процессе внутренняя энергия газа не изменяется, и количество полученного тепла Q1 равно работе А12. По формуле (2.38):
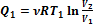 . (2.55)
. (2.55)
На участке 2-3 газ расширяется адиабатически. На участке 3‑4 он сжимается опять изотермически, для чего охладителю должно быть отдано тепло Q2. Работа на участке 3‑4 равна ‑ Q2, причем
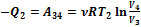 . (2.56)
. (2.56)
Наконец, на участке 4‑1 газ адиабатически сжимается, возвращаясь к исходному состоянию. Воспользуемся уравнением адиабаты (2.42), заменив в нем, согласно уравнению состояния PV, на ν· RT. Уравнение адиабаты принимает вид:
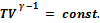 (2.57)
(2.57)
Для процессов 2‑3 и 4‑1 цикла Карно отсюда следует: 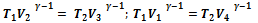 .
.
Разделив первое уравнение на второе, получим V 2 /V 1 = V 3 /V 4. После подстановки этого выражения в (2.56) найдем: 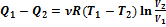 . (2.58)
. (2.58)
Подставляя (2.58) в формулу (2.54), получим выражение для КПД цикла Карно:
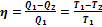 . (2.59)
. (2.59)
Из формулы (2.59) следует, что КПД тепловой машины определяется только разностью температур нагревателя и холодильника. КПД не зависит ни от свойств рабочего тела, используемого в машине, ни от свойств самой машины. Полученный результат показывает, что при T1 = T2 КПД машины равен нулю, т. е. машина не совершает работы. Работа максимальна (η = 1) при T2 = 0. Таким образом, машина тем выгоднее, чем ниже температура охладителя.
Теорема Карно гласит, что коэффициент полезного действия тепловой машины, работающей по циклу Карно, зависит только от температур 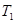 и
и 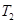 нагревателя и холодильника, но не зависит от устройства машины, а также от вида рабочего вещества.
нагревателя и холодильника, но не зависит от устройства машины, а также от вида рабочего вещества.
Вторая теорема Карно гласит – коэффициент полезного действия всякой тепловой машины не может превосходить коэффициент полезного действия идеальной машины, работающей по циклу Карно с теми же самыми температурами нагревателя и холодильника.
47. Понятие приведенной теплоты. Энтропия.
Из цикла Карно видно, что равны между собой отношения теплот к температурам, при которых они были получены или отданы в изотермическом процессе:
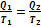
Отношение теплоты 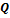 в изотермическом процессе к температуре, при которой происходила передача теплоты, называется приведенной теплотой
в изотермическом процессе к температуре, при которой происходила передача теплоты, называется приведенной теплотой  :
: 
Для подсчета приведенной теплоты в произвольном процессе необходимо разбить этот процесс на бесконечно малые участки, где Т можно считать константой. Приведенная теплота на таком участке будет равна 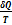
Суммируя приведенную теплоту на всех участках процесса, получим: 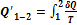
 Тогда в обратимом цикле Карно имеем:
Тогда в обратимом цикле Карно имеем:
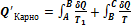 +
+ 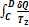 +
+ 
Этот результат справедлив для любого обратимого процесса.
Таким образом, для процесса, происходящего по замкнутому циклу
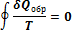
Из равенства нулю интеграла, взятого по замкнутому контуру, следует, что подынтегральное выражение 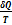 есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Это позволяет ввести новую функцию состояния S:
есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Это позволяет ввести новую функцию состояния S: 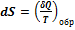
Функция состояния, полный дифференциал которой равен 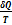 , называется энтропией (от греч. entropia – поворот, превращение) – мера способности теплоты превращаться в другие виды энергии.
, называется энтропией (от греч. entropia – поворот, превращение) – мера способности теплоты превращаться в другие виды энергии.
Энтропия S – это отношение полученной или отданной теплоты к температуре, при которой происходил этот процесс.
Понятие энтропии впервые введено Р. Клаузиусом в 1854 г.
Для обратимых процессов изменение энтропии равно 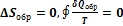
Это выражение называется равенство Клаузиуса.
48. Неравенство Клаузиуса. Статистическое толкование закона возрастания энтропии.
Дата публикования: 2015-11-01; Прочитано: 543 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
