 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Относительность расстояний
|
|
При выводе формулы 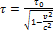 мы неявно предполагали, что расстояние
мы неявно предполагали, что расстояние  между зеркалами одинаково как в вагоне, так и на земле. Вертикальные размеры предметов являются одними и те же как в вагонной, так и в земной системе отсчёта. Чтобы убедиться в этом, давайте возьмём два одинаковых вертикальных стержня; один из них поместим в вагон, а другой оставим на земле. Оба стержня пусть будут на одной и той же высоте над землёй. Когда стержни поравняются друг с другом, концы одного стержня сделают засечки на другом стержне. Так вот, из принципа относительности следует, что эти засечки должны прийтись в точности на концы другого стержня. В самом деле, пусть по засечкам оказывается, например, что вагонный стержень короче земного, т. е. движущийся стержень короче покоящегося. Но по принципу относительности инерциальные системы отсчёта полностью равноправны. Давайте перейдём в систему отсчёта вагона: там вагонный стержень будет покоиться, а земной — двигаться. Тогда получится, что движущийся стержень длиннее покоящегося. Противоречие! Итак, поперечные размеры предметов одинаковы как в покоящейся, так и в движущейся системе отсчёта. Иначе обстоит дело с продольными размерами.
между зеркалами одинаково как в вагоне, так и на земле. Вертикальные размеры предметов являются одними и те же как в вагонной, так и в земной системе отсчёта. Чтобы убедиться в этом, давайте возьмём два одинаковых вертикальных стержня; один из них поместим в вагон, а другой оставим на земле. Оба стержня пусть будут на одной и той же высоте над землёй. Когда стержни поравняются друг с другом, концы одного стержня сделают засечки на другом стержне. Так вот, из принципа относительности следует, что эти засечки должны прийтись в точности на концы другого стержня. В самом деле, пусть по засечкам оказывается, например, что вагонный стержень короче земного, т. е. движущийся стержень короче покоящегося. Но по принципу относительности инерциальные системы отсчёта полностью равноправны. Давайте перейдём в систему отсчёта вагона: там вагонный стержень будет покоиться, а земной — двигаться. Тогда получится, что движущийся стержень длиннее покоящегося. Противоречие! Итак, поперечные размеры предметов одинаковы как в покоящейся, так и в движущейся системе отсчёта. Иначе обстоит дело с продольными размерами.
Вновь вернёмся к нашему вагону и рассмотрим стержень AB, расположенный вдоль вектора скорости вагона (рис. 7). Стержень, таким образом, двигается со скоростью  параллельно оси X.
параллельно оси X.
Пусть 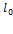 — длина неподвижного стержня, измеренная в вагоне. Она называется собственной длиной стержня. Через
— длина неподвижного стержня, измеренная в вагоне. Она называется собственной длиной стержня. Через  обозначим длину движущегося стержня, измеренную на земле.
обозначим длину движущегося стержня, измеренную на земле.
Для нахождения соотношения между  и
и 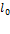 рассмотрим два события: 1) прохождение точки A мимо фиксированной точки O на оси X; 2) прохождение точки B мимо точки O.
рассмотрим два события: 1) прохождение точки A мимо фиксированной точки O на оси X; 2) прохождение точки B мимо точки O.
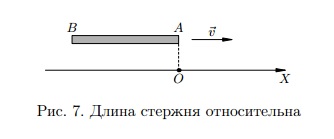 В земной системе отсчёта наши события происходят в одной точке O. Промежуток времени между этими событиями по земным часам пусть равен τ0 (это собственное время, разделяющее данные события). Очевидно, что
В земной системе отсчёта наши события происходят в одной точке O. Промежуток времени между этими событиями по земным часам пусть равен τ0 (это собственное время, разделяющее данные события). Очевидно, что 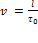 . В системе отсчёта вагона указанные события происходят в двух различных точках A и B. Промежуток времени между этими событиями по вагонным часам равен τ. Аналогично имеем:
. В системе отсчёта вагона указанные события происходят в двух различных точках A и B. Промежуток времени между этими событиями по вагонным часам равен τ. Аналогично имеем: 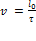 . Приравнивая правые части формул, получим:
. Приравнивая правые части формул, получим: 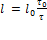 . Но в силу
. Но в силу 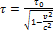 имеем:
имеем: 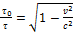 . Отсюда получаем окончательную формулу::
. Отсюда получаем окончательную формулу:: 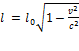 .
.
Как видим, собственная длина 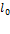 умножается на величину, меньшую единицы; стало быть, длина движущегося стержня будет меньше длины покоящегося стержня. Это так называемое лоренцево сокращение — все тела сокращают размеры в направлении своего движения. Подчеркнём ещё раз: длина стержня в системе отсчёта, относительно которой стержень движется, меньше длины этого же стержня в системе отсчёта, относительно которой он покоится. Данный эффект связан лишь с особенностями измерительных процедур, свойственных теории относительности. Никаких реальных «сжатий» в движущемся стержне, разумеется, не происходит.
умножается на величину, меньшую единицы; стало быть, длина движущегося стержня будет меньше длины покоящегося стержня. Это так называемое лоренцево сокращение — все тела сокращают размеры в направлении своего движения. Подчеркнём ещё раз: длина стержня в системе отсчёта, относительно которой стержень движется, меньше длины этого же стержня в системе отсчёта, относительно которой он покоится. Данный эффект связан лишь с особенностями измерительных процедур, свойственных теории относительности. Никаких реальных «сжатий» в движущемся стержне, разумеется, не происходит.
35. Масса в СТО, эквивалентность энергии и массы.
С точки зрения классической механики масса тела не зависит от его движения. Если масса покоящегося тела равна 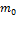 , то и для движущегося тела эта масса останется точно такой же. Теория относительности показывает, что в действительности это не так. Масса тела т, движущегося со скоростью v, выражается через массу покоя следующим образом:
, то и для движущегося тела эта масса останется точно такой же. Теория относительности показывает, что в действительности это не так. Масса тела т, движущегося со скоростью v, выражается через массу покоя следующим образом: 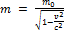 Масса — такая же относительная величина, как скорость, время, расстояние. Нельзя говорить о величине массы, пока не будет фиксирована система отсчета, в которой мы изучаем тело.
Масса — такая же относительная величина, как скорость, время, расстояние. Нельзя говорить о величине массы, пока не будет фиксирована система отсчета, в которой мы изучаем тело.
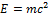 — уравнение из релятивистской физики, которое устанавливает взаимосвязь между энергией покоя и массой. Этот вид формулы
— уравнение из релятивистской физики, которое устанавливает взаимосвязь между энергией покоя и массой. Этот вид формулы 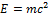 , является неудачным, так как речь идёт не о всякой энергии, а о энергии покоя
, является неудачным, так как речь идёт не о всякой энергии, а о энергии покоя 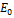 . Таким образом, следует писать формулу следующим образом
. Таким образом, следует писать формулу следующим образом 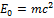 .
.
В специальной теории относительности (СТО), имеют место формулы, связывающие энергию тела, его скорость, импульс и массу:
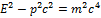
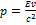
Подставим в формулу скорость 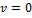 , тогда очевидно:
, тогда очевидно: 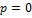 , теперь при таком рассмотрении из первого выражения нетрудно получить:
, теперь при таком рассмотрении из первого выражения нетрудно получить: 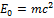 .
.
Эта формула предполагает, что, если тело имеет массу, оно обладает определённым количеством энергии — «энергией покоя». Даже если оно покоится и не обладает ни потенциальной энергией какого-либо типа, ни кинетической энергией, ни какой-либо другой, оно всё равно обладает некой энергией - энергией покоя.
Из классической физики известно, что полная энергия тела складывается из двух составляющих: кинетической и потенциальной. Первая связана только лишь с движением тела, вторая с наличием поля, в котором находится тело. Положим, что поля нет  , тогда полная энергия равна только лишь кинетической. Далее, свяжем систему отсчёта с телом
, тогда полная энергия равна только лишь кинетической. Далее, свяжем систему отсчёта с телом 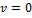 , тогда, очевидно, его кинетическая энергия будет равна
, тогда, очевидно, его кинетическая энергия будет равна 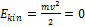 .
.
В итоге получим, что полная энергия тела будет равна нулю. Но это в классике. В релятивизме все иначе, с телом «останется» некоторая энергия, которая численно равна произведению массы этого тела на скорость света в квадрате. Легко понять, что в таком случае полная энергия и будет равна энергии покоя.
36. Молекулярная физика и термодинамика. Законы идеального газа и уравнение состояния.
Молекулярная физика и термодинамика - разделы физики, в которых изучаются макроскопические процессы, связанные с огромным числом содержащихся в телах атомов и молекул. Для изучения этих процессов применяют два принципиально различающихся (но взаимно дополняющих друг друга) метода: статистический (молекулярно-кинетический) и термодинамический.
Молекулярная физика - раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении. Процессы, изучаемые молекулярной физикой, являются результатом совокупного действия огромного числа молекул. Законы поведения огромного числа молекул изучаются с помощью статистического метода, который основан на том, что свойства макроскопической системы определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии и т.д.). Например, температура тела определяется средней скоростью хаотического движения его молекул и нельзя говорить о температуре одной молекулы.
Термодинамика - раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамика не рассматривает микропроцессы, которые лежат в основе этих превращений, а основывается на двух началах термодинамики - фундаментальных законах, установленных экспериментальным путем.
Статистические методы физики не могут быть использованы во многих разделах физики и химии, тогда как термодинамические методы универсальны. Однако статистические методы позволяют устанавливать микроскопическое строение вещества, тогда как термодинамические методы лишь устанавливают связи между макроскопическими свойствами. Молекулярно-кинетическая теория и термодинамика взаимно дополняют друг друга, образуя единое целое, но отличаясь методами исследования.
Опытные законы идеального газа
Закон Бойля-Мариотта: при T=const, m=const pV = const (изотермический процесс, рис.1).
Закон Гей-Люссака: при p=const, m=const V=VoaT (изобарный процесс, рис.2), при V=const, m=constp=poaT (изохорный процесс, рис.3).
Закон Авогадро: моль любого газа при одинаковой температуре и давлении занимает одинаковый объем Vm (при нормальных условиях Vm = 22.41.10-3 м3 ).
Закон Дальтона: давление смеси газов равно сумме парциальных давлений р1, р2,... рn входящих в нее газов p = p1+p2+...+pn. Парциальное давление - давление, которое производил бы газ, входящий в состав газовой смеси, если бы он занимал объем, равный объему смеси при той же температуре.
Уравнение состояния идеального газа (уравнение Клапейрона-Менделеева)
Функциональная связь между давлением, объемом и температурой называется уравнением состояния. Для идеального газа, используя законы Бойля-Мариотта, Гей-Люссака и Авогадро, можно получить:
уравнение Клапейрона-Менделеева для одного моля газа pVm = RT, (1a)
где R = 8.31 Дж/моль.К - газовая постоянная (она находится после подстановки в последнее уравнение нормальных условий)
уравнение Клапейрона-Менделеева для произвольной массы газа pV =(m/M)RT = nRT, (1b)
где М - масса одного моля (молярная масса), n = m/M - количество вещества.
Можно ввести постоянную Больцмана k = R/NA = 1.38.10-23 Дж/К и тогда уравнение Клапейрона-Менделеева имеет вид p = nkT, (1c)
где n = NA/Vm - число молекул в единице объема (концентрация молекул), т.е. при одинаковых температуре и давлении все газы содержат в единице объема одинаковое число молекул (в 1 м3 при нормальных условиях содержится NL = 2.68.1025 молекул - число Лошмидта).
37. Смесь идеальных газов. Закон Дальтона.
В практической деятельности чаще всего имеют дело не с однородными газами, а с их смесями: воздух, продукты сгорания топлива, горючие газовые смеси и т.п.. Поэтому в теплотехнике газовые смеси имеют важное значение.
В объеме, занимаемом газовой смесью, каждый газ, входящий в эту смесь, ведет себя так же, как он вел бы себя при отсутствии других составляющих смеси: распространяется по всему объему; создает давление (парциальное), определяемое температурой и объемом на единицу его массы; имеет температуру смеси.
Все газы делятся на два основных вида: идеальные и реальные.
Идеальным газом называется газ, удовлетворяющий следующим условиям:
· размеры молекул пренебрежительно малы
· соударения молекул происходят как соударения упругих шариков
· между молекулами не проявляются силы взаимодействия
Пример идеального газа – сильно разряженные газы (не превышающие атмосферное в 100 раз) при не очень низких температурах.
Такое понятие дало возможность построить молекулярно-кинетическую теорию, рассмотреть вопросы о вычислении теплоемкостей, явления переноса и др. В определенных границах выводы этой теории хорошо подтверждаются экспериментами.
Смесью газов называется совокупность нескольких разнородных газов, которые при рассматриваемых условиях не вступают друг с другом в химические реакции.
Смесь газов – гомогенная термодинамическая система (внутри которой нет поверхностей раздела, отделяющих друг от друга макроскопические части системы, различающиеся по своим свойствам и составу).
Смесь идеальных газов представляет собой идеальный газ, для которого справедливы законы и полученные для идеальных газов зависимости.
Для идеального газа давление определяется выражением 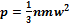
Количество молекул, входящих в данную смесь газов, равно сумме молекул газов, составляющих смесь
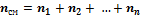
Произведение 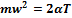 пропорционально абсолютной температуре газа, а поскольку все газы, входящие в смесь, имеют одинаковую температуру, то справедливо равенство
пропорционально абсолютной температуре газа, а поскольку все газы, входящие в смесь, имеют одинаковую температуру, то справедливо равенство 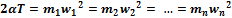
В соответствии с выражениями давление для смеси газов можно представить в виде суммы
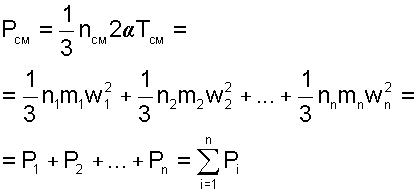 ,
,
где Pi- парциальные давления газов, составляющих смесь.
Это уравнение представляет математическое выражение закона Дальтона (1807 г.), в соответствии с которым, давление газовой смеси равно сумме парциальных давлений газов, входящих в смесь. Парциальное давление это давление, которое создает один из газов, составляющих смесь, при температуре смеси в случае заполнения им всего объема смеси. К сильно сжатым газам закон Дальтона неприменим, так же как и закон Бойля-Мариотта. Парциальное давление это реально существующая величина, поскольку каждый отдельный газ в смеси имеет температуру смеси и занимает весь объем смеси. Парциальное давление можно определить из уравнения Менделеева-Клапейрона:
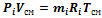 , где V см - объем, занимаемый всей смесью газов, mi - масса отдельного газа, входящего в смесь, Ri - газовая постоянная отдельного газа, T см - температура смеси газов.
, где V см - объем, занимаемый всей смесью газов, mi - масса отдельного газа, входящего в смесь, Ri - газовая постоянная отдельного газа, T см - температура смеси газов.
Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельности. (Строго говоря, закон применим только к идеальным газам, но с достаточно хорошим приближением он описывает также и реальные газы.)
Так же, закон Дальтона описывает связь растворимости компонентов газовой смеси, которая пропорциональна их парциальному давлению.
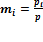 , где
, где 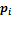 — Давление смеси газов,
— Давление смеси газов, 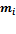 — Масса растворимого газа,
— Масса растворимого газа,  — Давление окружающей среды
— Давление окружающей среды
38. Основные уравнения МКТ строения газов.
Молекулярно-кинетическая теория — это раздел физики, изучающий свойства различных состояний вещества, основывающийся на представлениях о существовании молекул и атомов как мельчайших частиц вещества. В основе МКТ лежат три основных положения:
1. Все вещества состоят из мельчайших частиц: молекул, атомов или ионов.
2. Эти частицы находятся в непрерывном хаотическом движении, скорость которого определяет температуру вещества.
3. Между частицами существуют силы притяжения и отталкивания, характер которых зависит от расстояния между ними.
Дата публикования: 2015-11-01; Прочитано: 782 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
