 Основні положення МКТ, маса і розміри молекули, температура, основне рівняння МКТ ідеального газу, рівняння стану ідеального газу та ізопроцеси
Основні положення МКТ, маса і розміри молекули, температура, основне рівняння МКТ ідеального газу, рівняння стану ідеального газу та ізопроцеси
| №
| Основні положення МКТ
| Рисунок
| Дослідні обґрунтування положень МКТ
|
|
| Усі тіла складаються з найдрібніших частинок – атомів, йонів, молекул.
|
| a. Молекули і атоми можна бачити в електронний та тунельний
мікроскопи;
b. утворення мономолекулярних плівок;
c. змішування рідин та газів
(1л води + 1 л спирту < 2 л розчину).
| |
|
| Частинки перебувають у безперервному хаотичному тепловому русі.
|
| a. Дифузія – проникнення однієї речовини в міжмолекулярні
проміжки другої;
b. броунівський рух – хаотичний рух макроскопічних частинок, завислих у рідині чи газі, зумовлений ударами з боку молекул;
c. осмос – проникнення речовин через пористі перегородки (корені
рослин, легені, кишечник).
| |
|
| Між частинками існують сили взаємодії – притягання і відштовхування.
| 
| a. Збереження твердим тілом форми та об’єму, рідиною - об’єму;
b. виготовлення деталей методом порошкової металургії;
c. для стискання чи пресування потрібна велика сила.
| |
| | | | | | | | |
 Відносна молекулярна маса - відношення маси молекули даної речовини до 1/12 маси атома карбону:
Відносна молекулярна маса - відношення маси молекули даної речовини до 1/12 маси атома карбону: 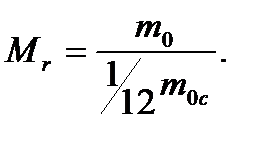
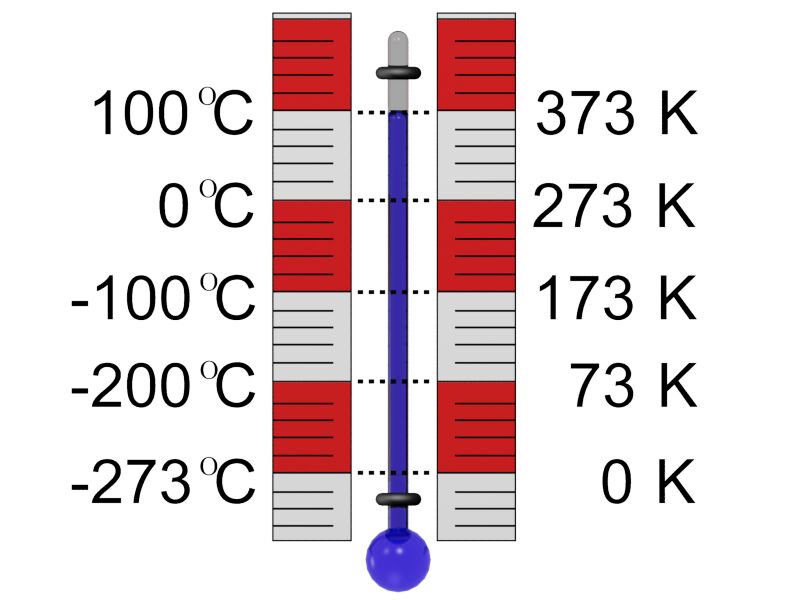
| Рисунок 3.2 – Температурні шкали
|
Кількість речовини – відношення числа атомів даної речовини до числа Авогадро.:
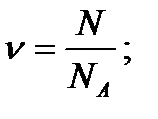
NA – число Авогадро – число атомів, яке міститься в 12 г карбону; NA =6,02·1023 моль-1; 1 моль будь-якій речовини містить NA атомів.
Молярна маса – це маса одного моля речовини: M = Mr ·10-3 кг/моль; M = m0·NА.
Маса: m = m0N; m = Mν; m = ρV.
Густина речовини – маса одиниці об’єму: ρ = n m0.
Концентрація молекул – число молекул в одиниці об’єму: 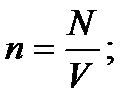
Ідеальний газ – це реальний газ, взаємодією між молекулами якого можна знехтувати
Основне рівняння МКТ: 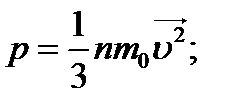
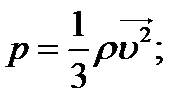
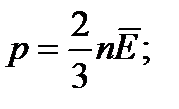
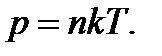
Закон Дальтона: Тиск у суміші хімічно не взаємодіючих газів дорівнює сумі їх парціальних тисків: p = p1 + p2 + p3 + … = (n1 + n2 + n3 + …) kT.
Середня кінетична енергія теплового руху молекул: 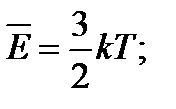
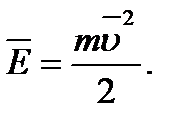
Абсолютна температура: Т=t+273
Рівняння Менделєєва-Клапейрона: 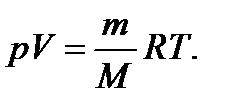
Газові закони
1. Об’єднаний газовий закон: 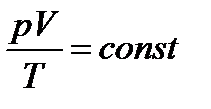 , або
, або 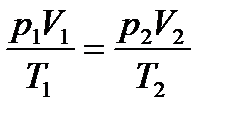 , якщо m = const. (рівняння Клапейрона);
, якщо m = const. (рівняння Клапейрона);
2. Закон Бойля-Маріота: Для даної маси газу, при постійній температурі, добуток тиску на об’єм є величиною сталою: 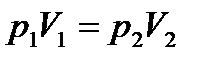 , якщо m = const, T = const.
, якщо m = const, T = const.
Ізотермічний процес - процес, який тече при постійній температурі.
3.
Закон Гей-Люсака: Для даної маси газу, при постійному тиску, відношення об’єму до абсолютної температури є величиною сталою:
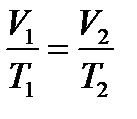
,
якщо m = const, p = const.
Ізобарний процес - процес, який тече при постійному тиску.
4. Закон Шарля: Для даної маси газу, при постійному об’ємі, відношення тиску до абсолютної температури є величиною сталою: 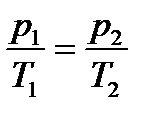 , m = const, V = const.
, m = const, V = const.
Ізохорний процес - процес, який тече при постійному об’ємі.

 Основні положення МКТ, маса і розміри молекули, температура, основне рівняння МКТ ідеального газу, рівняння стану ідеального газу та ізопроцеси
Основні положення МКТ, маса і розміри молекули, температура, основне рівняння МКТ ідеального газу, рівняння стану ідеального газу та ізопроцеси Відносна молекулярна маса - відношення маси молекули даної речовини до 1/12 маси атома карбону:
Відносна молекулярна маса - відношення маси молекули даної речовини до 1/12 маси атома карбону: 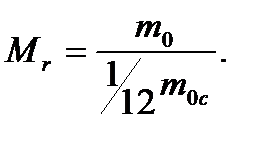
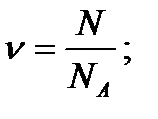
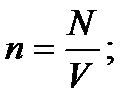
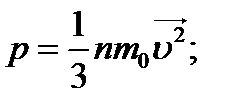
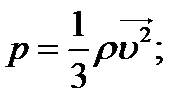
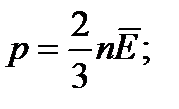
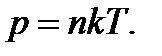
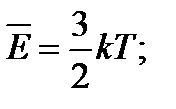
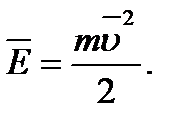
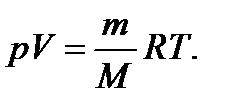
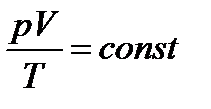 , або
, або 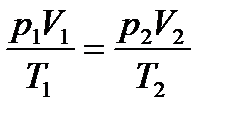 , якщо m = const. (рівняння Клапейрона);
, якщо m = const. (рівняння Клапейрона);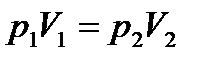 , якщо m = const, T = const.
, якщо m = const, T = const.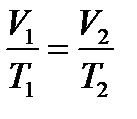 , якщо m = const, p = const.
, якщо m = const, p = const.
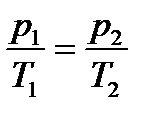 , m = const, V = const.
, m = const, V = const.
