 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Расчет термодинамических функций
|
|
Термодинамика реакций не зависит от механизма, имеет значение лишь степень превращения веществ. Термодинамические величины, обычно, вычисляются на основании измерений температурной зависимости скорости реакции по уравнению Аррениуса:
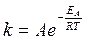 (3.11)
(3.11)
где k – константа скорости реакции при температуре Т;
EA – энергия активации;
А – частотный фактор Аррениуса, характеризует вероятность того, что при столкновении молекул исходных веществ произойдет разрыв старых и образование новых связей;
R – газовая постоянная.
Если известны три и более константы скорости реакции, определенные при различных температурах, можно рассчитать энергию активации переходного состояния и частотный фактор Аррениуса.
Для этого удобно пользоваться графическим методом (рис.3.5), вытекающим из логарифмической формы уравнения Аррениуса:
 lnk = lnA – EA /RT
lnk = lnA – EA /RT
| Рис.3.5. Определение энергии активации по экспериментальным данным |
Определив энергию активации (EA) и вычислив частотный фактор Аррениуса (А), рассчитывают термодинамические характеристики реакции в стандартных условиях:
ΔHoT – энтальпия активации или тепловой эффект реакции:
∆Ho= EoA – RT (3.12)
она, обычно, равна или близка к разности ΔЕ внутренних энергий исходных и конечных веществ;
ΔSoT – энтропия активации, энтропия является термодинамической мерой статистической вероятности системы; ее можно рассчитать по уравнению:
ΔSoT= 4,576 lg (A/T) – 49,21 (3.13)
ΔGoT – изобарно-изотермический потенциал или энергия Гиббса, характеризует вероятность протекания реакции:
ΔG˚ = ΔH˚ – T · ΔS˚ (3.14)
Дата публикования: 2015-11-01; Прочитано: 323 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
