 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетика реакции этерификации
|
|
Зависимость скорости реакции от концентрации реагирующих веществ выражается основным законом кинетики в виде уравнения:
 (3.1)
(3.1)
где k – константа скорости реакции;
Ci – концентрация i-го реагента;
m – количество реагентов;
n – порядок реакции по i-му реагенту.
Порядок реакции является эмпирической величиной. Порядок реакции по i-му реагенту называется частным порядком. Он численно равен показателю степени, с которым концентрация i-го реагента входит в уравнение скорости реакции. Общий порядок реакции равен сумме частных порядков реакции по всем реагентам. Так как
Ci = Ci,0 · (1–Хi), (3.2)
где Ci,0 – начальная концентрация i-го реагента, а Х i – степень превращения i-го реагента, то скорость реакции можно выразить через степень превращения:
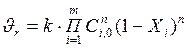 (3.3)
(3.3)
Реакция этерификации является реакцией второго порядка, кинетическое уравнение имеет вид:
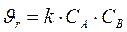 (3.4)
(3.4)
Исследование кинетики гомогенных жидкофазных процессов проводят, в основном, в реакторах периодического действия – РИС-П. При этом задача сводится к экспериментальному определению функций зависимости концентрации или степени превращения от времени и последующему их анализу. На практике используют интегральный и дифференциальный методы определения порядка реакции и анализа кинетических данных.
Интегральный метод удобен для анализа простых кинетических уравнений, описывающих элементарные реакции, и заключается в следующем:
1. Предполагают механизм реакции и находят соответствующее уравнение скорости. Это уравнение в соответствии с основным законом кинетики в системе с постоянным объемом имеет вид:
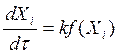 или
или 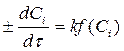 (3.5)
(3.5)
2. После разделения переменных и интегрирования уравнения получают:
 (3.6)
(3.6)
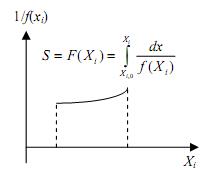
Если интеграл F(Xi) трудно найти аналитически, используют графический метод. Он сводится к определению площади под кривой в координатах (рис.3.1):
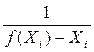 (3.7)
(3.7)
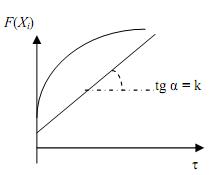
3. Строят график в координатах F(Хi) – τ (рис.3.2). Если он является прямой линией, то принятое уравнение согласуется с экспериментальными данными.
| 
|
| Рис.3.1. Графическое интегриро- вание кинетического уравнения | Рис.3.2. Проверка кинетического уравнения интегральным методом |
4. Если экспериментальные точки не ложатся на прямую, необходимо исследовать другие уравнения (1-го, 2-го и 3-го порядков), пока не будет получено удовлетворительное соответствие.
Дифференциальный метод заключается в непосредственной проверке дифференциальной формы кинетического уравнения. Программу экспериментов в этом случае надо планировать так, чтобы сразу получить полную форму кинетического уравнения:
1. На основе предполагаемого механизма реакции выбирают
кинетическое уравнение:
± dСi /dτ = k ƒ(Ci ) (3.8)
2. По экспериментальной кривой в координатах Ci – τ графическим дифференцированием находят dСi /dτ в различные моменты времени и соответствующие этой скорости (υr) концентрации реагирующих веществ (Ci).
3. Составляют таблицу значений концентраций исходных реагирующих веществ и производной dСi /dτ через определенные интервалы времени.
4. Строят график зависимости dСi /dτ – ƒ(Ci ). Если получают прямую, проходящую через начало координат, то уравнение скорости соответствует экспериментальным данным (рис. 3.3).
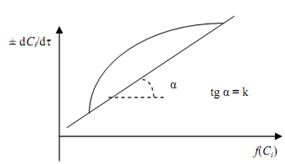
Рис.3.3. Проверка кинетического уравнения дифференциальным методом
5. Если график в координатах dСi /dτ – ƒ(Ci ) не является прямой, следует рассмотреть другое кинетическое уравнение.
Дата публикования: 2015-11-01; Прочитано: 840 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
