 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Расчет порядка реакции
|
|
1. Рассчитывают степень превращения хлорангидрида бензойной кислоты (А). Т.к. количество молей выделившегося хлороводорода равно количеству молей прореагировавшего хлорангидрида бензойной кислоты, то
ХА = 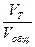 ;
;
VТ - текущий объем раствора 0,1 Н КОН, расходуемый на нейтрализацию хлороводорода, получаемый сложением с предыдущим объемом: 4, 8, 12 мл и т.д.
Vобщ – общий объем раствора 0,1 Н КОН, пошедший на эксперимент, мл.
2. Определяют текущую концентрацию СА, рассчитав степень превращения ХА,
СА = СА,0 (1–ХА)
и строят по полученным данным графическую зависимость CA = f(τ) (рис. 4.1)
3. Определяют k – константу скорости:
k = 1/ τ · (1/ СА – 1/ СА,0),
где СА и СА,0 – текущая и начальная концентрации;
τ – время в минутах.
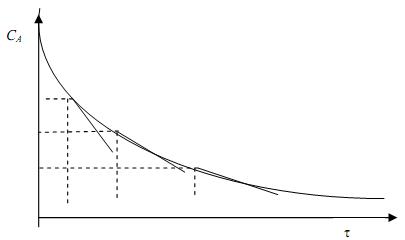
Рис. 4.2. Зависимость концентрации реагента А от времени реакции
4. Рассчитывают порядок реакции графическим методом, как описано в подразделе 3.3. Для этого рассчитывают и вносят в табл. 4.4 следующие величины:
Таблица 4.4
Данные для расчёта общего порядка реакции
| номер | τ, с | CA, моль/л | ln(CA) | ΔСА, моль/л | Δτ, | υ, моль/л·с | ln(υ) | n |
1. На кинетической кривой (рис. 4.2) выбирают 4–5 точек и проводят касательные.
2. Рассчитывают скорости реакции по веществу А в соответствующий момент времени по тангенсам угла наклона касательных υr = dCA/d τ или приближенно
υr = ΔCA/Δ τ;
3. Рассчитывают логарифмы ln CA и ln υr;
4. Строят график зависимости ln CA от ln υr и по тангенсу угла определяют порядок реакции.
Расчёт активационных параметров реакции
1. Провести три опыта при различных температурах (задаётся преподавателем) и рассчитать значения К в соответствии с п.п. 1-3.
2. Рассчитать значения логарифмов К и обратных температур 1/Т. Построить график зависимости lg K – 1/T и по тангенсу угла наклона определить энергию активации Еакт.
3. По найденному значению энергии активации рассчитывают энтальпию реакции (Δ HоТ) по уравнению (3.12), энтропию реакции (Δ SоТ) по уравнению (3.13) и изобарно-изотермический потенциал (Δ GоТ) по уравнению (3.14).
4. Записывают полученное кинетическое уравнение (см. уравнение 3.15).
Дата публикования: 2015-11-01; Прочитано: 287 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
