 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическое равновесие. Химические процессы подразделяются на обратимые и на необратимые
|
|
Химические процессы подразделяются на обратимые и на необратимые. Понятие химическое равновесие применимо только к обратимым реакциям. В действительности же все химические процессы обратимы, так как при соответствующих условиях любой процесс может протекать с заметной скоростью, как в прямом, так и в обратном направлении.
Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции равна скорости обратной реакции.
К обратимым реакциям можно отнести синтез аммиака из элементов его составляющих: 
N2 + 3H2 «2NH3 
окисление сернистого альдегида до серного
SO2 + 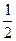 O2 «SO3
O2 «SO3
Синтез сложных эфиров из соответствующих органических кислот и спиртов, например:
CH3COOH + C2H5OH «CH3COOC2H5 + H2O
Все обратимые процессы во времени стремятся к равновесию, при котором скорости прямого и обратного процесса уравниваются, в результате чего соотношение компонентов в реакционной массе остается неизменным, пока в элементе не изменяются параметры технологического режима.
Устойчивое равновесие характеризуется:
a) неизменностью равновесного состояния системы во времени при постоянных внешних условиях;
b) подвижностью равновесия, т.е. самопроизвольным восстановлением состояния равновесия после снятия внешнего воздействия, вызвавшего отклонение системы от положения равновесия;
c) динамическим характером равновесия, т.е. установлением и сохранением равновесия вследствие равенства скоростей прямого и обратного процессов;
d) минимальным значением энергии Гиббса /G/ в изобарно-изотермических и энергией Гельмгольца /F/ в изохорно- изотермических процессах (DG=0, DG<0; DF<0).
Качественно подвижное равновесие определяется принципом Ле-Шателье, а количественно – константой равновесия.
При анализе идеальных обратимых химических процессов константу равновесия выражают через концентрации газов (жидкостей) в молях•литр-1
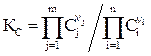 (2.1)
(2.1)
через парциальные давления газов, участвующих в реакции
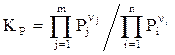 (2.2)
(2.2)
через мольные доли
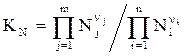 (2.3)
(2.3)
а также через число молей веществ участников реакции
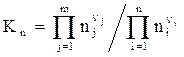 (2.4)
(2.4)
В уравнениях (2.1-2.4) П – символ произведения; n – стехиометрический коэффициент; j,i – индексы, соответственно относящиеся к продуктам реакции и исходным веществам.
Для реальных процессов константу равновесия выражают через летучести и активности
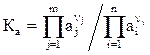 (2.5)
(2.5)
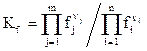 (2.6)
(2.6)
При небольших давлениях и практически при любых температурах
Ka = Kf = Kp = KN·P Dn = Kn 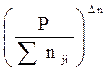 (2.7)
(2.7)
Константа равновесия является величиной постоянной (при данных Р и Т) для каждой реакции. Однако, также как и тепловой эффект константа равновесия зависит от температуры.
Дата публикования: 2015-11-01; Прочитано: 323 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
