 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Дәріс 25, 26– Өндірістік катализ
|
|
Мазмұны:
1. Өндірістік катализ. Катализаторлардың қасиеттері.
2. Біртекті катализ. Біртекті катализдің механизмі.
1. Катализ деп, реагенттермен химиялық аралық әрекеттесу реакцияларына түсіп, бірақ катализ аяқталған соң бастапқы құрамын қалпына келтіретін «катализатор» атты заттарды қолдану арқылы химиялық реакциялардың жылдамдығын қоздырып, үдетуді атайды.
Катализдік процестер, реагенттер мен катализаторлардың физикалық күйіне байланысты, екі топқа бөлінеді: біртекті, әртекті.
Катализатордың қатысуымен реакциялық жолдың өзгергенінде, реакция катализатордың қатысуынсыз өтетін тура реакцияға қарағанда активтену энергиясын аз қажет ететін қарапайым сатылардың біразы арқылы өтеді. Катализатордың негізгі технологиялық сипаттамалары: активтілігі, селективтілігі, механикалық тұрақтылығы, төзімділі, уланбауы, қыздырғанда балқымау және т.б.
Катализдік емес реакциямен салыстырғанда катализатордың үдетуші әрекеті, катализатор қатысқан kкат және катализаторсыз k реакциялардың жылдамдығының тұрақтылырының қатынасымен анықталады, оны катализаторлардың активтілігі А деп атайды: 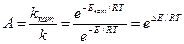 (2), мұндағы ∆Е – катализдік емес реакциямен салыстырғандағы катализдік реакцияның активтену энергиясының төмендеуі.
(2), мұндағы ∆Е – катализдік емес реакциямен салыстырғандағы катализдік реакцияның активтену энергиясының төмендеуі.
∆Е=Е-Екат.
Температурамен жану Т3 катализаторы төменгі температура деп- процесстің басталуының технологиялық мақсатты жылдамдық үшін жеткілікті жүруі. Катализатордың белсенділігі жоғары болған сайын, оның жану температурасы төмен болады, яғни (теңдеу) Тз=К/А, мұнда, К – катализатордың табиғатынанан тәуелді константа.
Селективтілігі (таңдамалдылығы) катализатордың деп- термодинамикалық жүйеде бірнеше реакциялар жүру мүмкін кезде, реакциялардың біреуін ғана жылдамдату ерекшелігін атайды:  (6), мұнда Gо—өнім мөлшері; Gбас—негізгі бастапқы реагенттің мөлшері; vо/vбас —негізгі бастапқы заттан өнім түзілгенде стехиометриялық коэффициенттердің қатынасы.
(6), мұнда Gо—өнім мөлшері; Gбас—негізгі бастапқы реагенттің мөлшері; vо/vбас —негізгі бастапқы заттан өнім түзілгенде стехиометриялық коэффициенттердің қатынасы.
Жалпы (интегралды) селективтілікті мына формуламен анықтауға болады 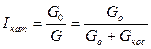 (7), где Gо — негізгі өнімге айналған негізгі реагент мөлшері; Gкос — қосалқы реакцияға түскен бастапқы зат мөлшері; G —негізгі бастапқы реагенттің жалпы мөлшері.
(7), где Gо — негізгі өнімге айналған негізгі реагент мөлшері; Gкос — қосалқы реакцияға түскен бастапқы зат мөлшері; G —негізгі бастапқы реагенттің жалпы мөлшері.
2. Гомогенді катализдің механизмі сол фазадағы реагенттер мен катализаторлар арасында тұрақсыз, арлық қосылыстардың түзілуінен тұрады, олар ыдырағаннан кейін реакция өнімі түзіледі, ал катализатор бастапқы қалпына келтіріледі. Мысалы, каталитикалық емес бимолекулярлы реакция схема бойынша жүреді А+В -> (АВ)* -> D+…, мұнда АВ* - активті комплекс.
Катализатор К қатысында реакция үш саты бойынша жүреді:
1) катализатор және бастапқы заттың біреуімен әрекеттесу нәтижесінде аралық өнімнің түзілуі: А + К ↔ АК (а)
2) аралық өнімнің АК екінші компоненттпен В әрекеттесу нәтижесінде активті комплекс түзу: АК + В → (АВ)*К (б)
активті комплекс
3) соңғы өнімдердің түзілуі және катализатор регенерациясы: (АВ)* К →D+К+ …(в)
Мұнда k1, k2, k3 и k4 — сәйкес реакциялардың жылдамдық константалары.
Гомогенді катализдік процестің жылдамдығы бастапқы заттар мен катализатордың концентрацияларының көбеюімен массалардың әрекеттесу заңына сәйкес өседі. Гомогенді –катализдік реакциялардың жылдамдығына температураның, қысымның, және араластырудың әсері гомогенді процестердің жалпы кинетикалық зандылықтарына ұқсас. Гомогенді катализдің кемшілігі –соңғы өнімдік қоспадан катализаторды бөліп алудың қиындығы болып табылады, соның нәтижесінде катализатордың бір бөлігі қайтпастан жоғалады, ал өнім катализатормен ластанады.
Өзін-өзі бақылауға арналған сұрақтар:
1. Катализатор дегеніміз не?
2. Катализатор не үшін қолданылады?
3. Катализдің түрлері
Ұсынылған әдебиеттер:
1. Общая химическая технология: в 2-х ч.,/под ред. И.П. Мухленова. М:1984.
2. Кутепов А.М. и др. Общая химическая технология. М:1990.
3. Основы химической технологии/под ред. И.П. Мухленова М:1991.
4. Вольфкович С.И. Общая химическая технология. М: 1959
5. Соколов Р.С. Химическая технология: в 2-х т. М: 2000.
Дата публикования: 2015-10-09; Прочитано: 2169 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
