 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кислотные гидроксиды (оксокислоты)
|
|
Оксокислоты – это кислородсодержащие соединения с общей формулой НnЭОm, где Э – кислотообразующий элемент, а ЭОmn– – кислотный остаток. Атомы водорода в формулах оксокислот ставят всегда на первое место. Оксокислоты как и все соединения имеют систематические и традиционные названия. Систематические названия
используются для малоизвестных кислот, например:
| H2S2O2 – диоксодисульфат диводорода | H4I2O9 – нонаоксодииодат(VII) водорода |
Для хорошо известных кислот используются чаще всего традиционные названия. Традиционные названия складываются из названия кислоты, выраженного прилагательным и группового слова кислота, например:
| H3PO4 – ортофосфорная кислота | H2SO4 – серная кислота |
В названиях оксокислот для обозначения степени окисления элемента применяют различные суффиксы. Для кислот, в которых кислотообразующий элемент находится в высшей степени окисления применяют суффиксы –н; – ов, –ев, например:
| HClO4 – хлорная кислота | H2SeO4 – селеновая кислота |
| H2SO4 – серная кислота | H4SiO4 – ортокремниевая кислота |
Для промежуточной степени окисления суффикс –новат:
| HClO3–хлорноватая кислота | HIO3–иодноватая кислота |
Для степени окисления +III – +IV суффикс –ист:
| HNO2 – азотистая кислота | H2SeO3 – селенистая кислота |
Для низшей степени окисления +I суффикс –новатист
| HClO – хлорноватистая кислота | HBrO – бромноватистая кислота |
Большинство кислотных гидроксидов в отличие от основных и амфотерных находятся в мета- форме, однако известны кислоты, которые могут находиться и в мета- и в орто- форме. Например:HAsO2–метамышьяковистая кислота; H3AsO3–ортомышьяковистая кислота
В таблице 1 приведены традиционные названия кислот и их анионов.
Таблица 1. Традиционные названия кислот и их анионов.
 Формула Название Формула Название
|  Формула иона Название Формула иона Название
| ||||||
HAsO2 метамышьяковистая
H3AsO3 ортомышьяковистая
H3AsO4 мышьяковая
 HBrO бромноватистая
HBrO3 бромноватая HBrO бромноватистая
HBrO3 бромноватая
 HBrO4 бромная
H2CO3 угольная HBrO4 бромная
H2CO3 угольная
 HClO хлорноватистая
HClO2 хлористая
HClO3 хлорноватая
HClO хлорноватистая
HClO2 хлористая
HClO3 хлорноватая
  HClO4 хлорная
H2CrO4 хромовая HClO4 хлорная
H2CrO4 хромовая
 H2Cr2O7 дихромовая
HIO иодноватистая
HIO3 иодноватая H2Cr2O7 дихромовая
HIO иодноватистая
HIO3 иодноватая
 H5IO6 ортоиодная H5IO6 ортоиодная
 HMnO4 марганцовая
HNO2 азотистая
HNO3 азотная HMnO4 марганцовая
HNO2 азотистая
HNO3 азотная
H3PO4 ортофосфорная
H2SO4 серная H2S2O7 дисерная H2S2O6(O2) пероксодисерная
H2SO3S тиосерная H2SeO3 селениcтая
— — — — — — — — — — — — — — — | AsO2 – метаарсенит
AsO33– ортоарсенит
AsO43– арсенат
BrO– гипобромит
BrO3– бромат
BrO4– пербромат
CO32 – карбонат
HCO3– гидрокарбонат
ClO– гипохлорит
ClO2– хлорит
ClO3– хлорат
 ClO4– перхлорат
CrO42 – хромат
HCrO4– гидрохромат
Cr2O72 – дихромат
IO– гипоиодит
IO3– иодат
IO65– ортопериодат
MnO4– перманганат
NO2– нитрит
NO3– нитрат
PO43– ортофосфат
HPO42– гидроортофосфат
H2PO4– дигидроорто
-фосфат
P2O74– дифосфат
ReO4– перренат
SO42– сульфат
HSO4– гидросульфат
S2O72– дисульфат
S2O6 (O2)2– пероксоди
-сульфат
SO3S2– тиосульфат
SeO32– селенит
SeO42– селенат
SiO44– ортосиликат
TeO66– ортотеллурат
BO2– метаборат
BO3– ортоборат
B4O72 – тетраборат
BiO3– висмутат
FeO42 – феррат
GeO32 – германат
MnO42 – манганат
MoO42 – молибдат ClO4– перхлорат
CrO42 – хромат
HCrO4– гидрохромат
Cr2O72 – дихромат
IO– гипоиодит
IO3– иодат
IO65– ортопериодат
MnO4– перманганат
NO2– нитрит
NO3– нитрат
PO43– ортофосфат
HPO42– гидроортофосфат
H2PO4– дигидроорто
-фосфат
P2O74– дифосфат
ReO4– перренат
SO42– сульфат
HSO4– гидросульфат
S2O72– дисульфат
S2O6 (O2)2– пероксоди
-сульфат
SO3S2– тиосульфат
SeO32– селенит
SeO42– селенат
SiO44– ортосиликат
TeO66– ортотеллурат
BO2– метаборат
BO3– ортоборат
B4O72 – тетраборат
BiO3– висмутат
FeO42 – феррат
GeO32 – германат
MnO42 – манганат
MoO42 – молибдат
 PO3- метафосфат
SO32– сульфит
HSO3– гидросульфит
TeO42– метателлурат
VO3– метаванадат
VO43 – ортованадат
WO42 – вольфрамат PO3- метафосфат
SO32– сульфит
HSO3– гидросульфит
TeO42– метателлурат
VO3– метаванадат
VO43 – ортованадат
WO42 – вольфрамат
|
Примечания к таблице.
Прочерк в таблице означает, что оксокислота неизвестна в свободном виде или в кислом водном растворе.
Физико-химические исследования последних десятилетий позволили уточнить структуры ряда кислот, что повлекло за собой изменения их химических формул и названий.
Ортоборную кислоту обычно изображают формулой H3BO3. Установлено, что эта формула не соответствует кислотным свойствам соединения, так как ни один протон соединения не является кислотным. Строение кислоты правильно отражает формула B(OH)3 (тригидроксид бора). Соединение является слабой одноосновной кислотой, кислотные свойства обусловлены диссоциацией одного из протонов воды, присоединённой ковалентной связью к тригидроксиду бора. В растворе существует следующее равновесие:
B(OH)3 + H2O = [B(H2O)(OH)3]
[B(H2O)(OH)3] + H2O 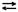 [B(OH)4] – + H3O +
[B(OH)4] – + H3O +
Однако, при сплавлении тригидроксида бора с карбонатами щелочных металлов получаются соединения типа Li3BO3 . В водном растворе ортобораты щелочных металлов разлагаются. Анионы H2BO3–, HBO32– и BO33– в водных растворах не обнаружены.
Метаборат-анион BO2– (см. табл.) также не существует в водном растворе. α,β,γ –метаборные кислоты (HBO2)n являются твердыми полимерными соединениями. Метабораты металлов могут быть получены при сплавлении буры со щёлочью или с оксидами металлов. При внесении в воду они разлагаются.
Тетраборат-анион B4O72– ,указанный в таблице, в растворе не обнаружен. Он входит в состав буры Na2B4O7•10H2O (более правильная формула Na2[B4O5(OH)4] •8H2O). В водном растворе это соединение гидролизуется с изменением состава аниона. Конечный продукт гидролиза – тригидроксид бора.
Анион PO3– (см. в табл.) в растворе не обнаружен. HPO3 – «метафосфорная кислота» не существует в виде индивидуального соединения, отвечающего этой формуле. Метафосфорные кислоты – это полимерные соединения, соответствующие формуле (HPO3)n где n = 3,4,6. Чаще всего это циклические соединения, состоящие из трёх – четырёх октаэдров, соединённых атомами кислорода. При взаимодействии с водой циклические соединения постепенно разрушаются, в результате образуется сначала дифосфорная кислота с формулой H4P2O7, затем ортофосфорная кислота с формулой H3PO4.
Существуют кислородсодержащие кислоты фосфора со степенью окисления фосфора +III и +I. Формула фосфористой кислоты H3PO3, которую часто используют в учебниках, не соответствует кислотным свойствам соединения, поскольку только два протона из трёх связаны с фосфором через кислород. Третий протон связан непосредственно с фосфором ковалентной связью.
OH
|
H – P = O
|
OH
Поэтому правильная формула фосфористой кислоты H2(PHO3) Систематическое название такого соединения триоксогидрофосфат (III) водорода.
Аналогичная кислота, содержащая фосфор в степени окисления +I (фосфорноватистая), которую изображают иногда формулой H3PO2, является одноосновной кислотой, так как имеет только один кислотный протон, связанный с фосфором через атом кислорода.
H
|
H – P = O
|
OH
Правильная формула такого соединения H(PH2O2). Систематическое название фосфорноватистой кислоты – диоксодигидрофосфат (I) водорода.
Диоксид серы – газ, при растворении в воде образует полигидрат диоксида серы SO2•nH2O.
В растворе устанавливаются следующие равновесия:
SO2 + nH2O  SO2 • nH2O
SO2 • nH2O
SO2 • nH2O + H2O  HSO3ˉ + H3O+ + (n-1)H2O
HSO3ˉ + H3O+ + (n-1)H2O
HSO3- + H2O 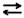 SO32- + H3O+
SO32- + H3O+
В индивидуальном виде «сернистая кислота» с формулой «H2SO3» не выделена, поэтому употреблять соответствующую формулу и название не рекомендуется.
Систематические названия подобных гидратированных кислотных оксидов таковы:
| SO2•nH2O – полигидрат оксида серы (IV) | MoO3•nH2O – полигидрат оксида молибдена (VI) |
| Sb2O5•nH2O – полигидрат оксида сурьмы (V) | SnO2•nH2O – полигидрат оксида олова (IV) |
Оксокислоты, содержащие пероксидную группу -O-O-, получили групповое название пероксокислоты. Примеры традиционных названий пероксокислот:
H2SO3(O2) – пероксомоносерная кислота
H2S2O6(O2) –пероксодисерная кислота
H4P2O6(O2) – пероксодифосфорная кислота.
Кислоты, образованные из оксокислот путём замещения одного кислорода на серу, называют тиокислотами. В формулах тиокислот атомы серы помещают на последнее место:
H2SO3S – тиосерная кислота (не рекомендуется писать её формулу как H2S2O3)
H3PO3S – тиофосфорная кислота
Оксокислоты с общей формулой H2(O3S – Sn – SO3) называются политионовыми кислотами. Традиционные названия этих кислот:
| H2S4O6 – тетратионовая | H2S5O6 – пентатионовая |
Числовая приставка указывает общее число атомов серы в молекуле.
СОЛИ
Соли – это сложные вещества, в состав которых входят катионы и анионы (кислотные остатки).
Дата публикования: 2015-10-09; Прочитано: 1780 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!

 H4SiO4 ортокремниевая
H4SiO4 ортокремниевая H6TeO6 ортотеллуровая
H6TeO6 ортотеллуровая