 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методика розрахунку температури спалаху з врахуванням
|
|
Структури речовини
1. Визначається температуру кипіння речовини;
2. Записується структурна формула речовини
4. Визначається кількість структурних груп lj , та показник структурної групи aj
5. Визначаються температура спалаху рідини.
Приклад розв’язування задачі
Визначити температуру спалаху етиленгліколю C2H6O2, при стандартних умовах.
1. Визначаємо температура кипіння рідини tкип = 197.8 оС;
2. Записуємо структурну формулу етиленгліколю C2H6O2-
3. Визначаємо кількість структурних груп lj , та показник структурної групи aj
l1 С – С = 1 ajн = -2,03
l2 С –Н = 4 ajн = 1,105
l3 С –О = 2 ajн = 2,47
l4 О – Н = 2 ajн = 23,90
4. Визначаємо температуру спалаху етиленгліколю.
tсп = - 73.14 +0.659*197.8+1,105*4+-2,03*1+2,47*2+23,90*2=112,3 оС.
Висновок: Таким чином можна зробити висновок, що етиленгліколь має температуру спалаху 112,3 оС, і відноситься до горючих рідин.
Емпірична формула з урахуванням залежності зміни температури спалаху у гомологічних рядках
tсп = а + b* tкип, оС (36)
де а, b - емпіричні константи для деяких гомологічних рядів (таблиця № 16 додатку).
Методика розрахунку температури спалаху з урахуванням
залежності зміни температури спалаху у гомологічних рядках.
1. Визначається температуру кипіння речовини;
2. Записуються емпіричні константи а, b щодо речовини
3. Визначаються температура спалаху рідини.
Приклад розв’язування задачі
Задача
Визначити температуру спалаху, клас і розряд дихлоретану С2Н4Сl2.
1. По довідковій літературі знаходимо температуру кипіння та молярну теплоту згорання (tкип = 57.3 оС).
2. По таблиці № 9 додатку знаходимо емпіричні константи а та b
а = -55,70;
b = 0,643.
3. Визначаємо температуру спалаху по формулі
tсп = а + b* tкип, = -55,7 + 0,046 * 57,3 = -18,3 оС
Висновок: дихлоретан є постійно небезпечною легкозаймистою рідиною (ПНЛЗР).
10. ТИСК НАСИЧЕНОЇ ПАРИ ТА ВИЗНАЧЕННЯ ПОЖЕЖОВИБУХОНЕБЕЗПЕКИ РІДИНИ ПРИ ВИЗНАЧЕНИХ УМОВАХ.
Концентрація насиченої пари рідини відносно її тиску. Фактичну концентрацію пари можна визначити з формули.
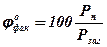 , % (37)
, % (37)
де Рп – тиск насиченої пари, кПа;
Рзаг – загальний тиск горючої суміші, кПа.
Тиск насиченої пари можна визначити методом лінійної інтерполяції та з формули Антуану.
Визначення тиску насиченої пари методом лінійної інтерполяції
Розрахунок тиску та фактичної концентрації насиченої пари при заданої температурі методом лінійної інтерполяції проводиться у наступному порядку:
1. По таблиці № (10) додатків визначаються два значення температури t1 і t2, що будуть близькими до заданого tфак.  (38)
(38)
Для визначається значення тиску при заданих температурах: тиск Р1 для температури t1 і тиск Р2 відповідно для температури t2.
2. Проводиться розрахунок тиску насиченої пари при заданої температурі з формули
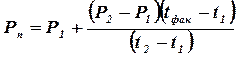 (39)
(39)
3. Проводиться розрахунок фактичної концентрації насиченої пари при заданих умовах по формулі
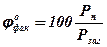 (40)
(40)
Приклад розв'язування задачі
Визначити тиск насиченої пари, концентрацію пари та ступень пожежовибухонебезпеки етилформіату C3H6O2 при температурі tфак = 5 оС та загальному тиску Рзаг = 105 кПа, якщо концентраційні межі розповсюдження полум'я для етилформіату встановлюють 2.85 - 16.71 %. Складаємо рівняння реакції горіння етилформіату
1. По таблиці № (10) додатків визначаємо два значення температури t1 і t2, що будуть близькими до заданого tфак.

2. Проводимо розрахунок тиску насиченої пари при заданій температурі
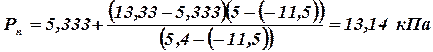
3. Визначаємо фактичну концентрацію насиченої пари при заданих умовах
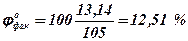
4. Визначаємо ступень пожежовибухонебезпеки насиченої пари етилформіату
jон = 2,85 % > jофак = 12,51 % < jов = 16.71 %
Висновок: при заданих умовах насичена пара етилформіату буде утворювати вибухонебезпечну концентрацію.
Визначення тиску насиченої пари з використанням констант Антуану
Тиск насиченої пари при будь якої температурі можна визначити з використанням констант Антуану по формулі
 , (41)
, (41)
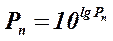 , кПа (42)
, кПа (42)
Приклад розв'язування задачі
Задача
Визначити тиск насиченої пари та фактичну концентрацію насиченої пари етилацетату C4H8O2 при температурі tфак = 20 оС та загальному тиску Рзаг = 100 кПа.
1. По таблиці (10) додатку визначаємо константи Антуана
A = 6.2267; B = 1244.95; Ca = 217.88
2. Визначаємо тиск насиченої пари при заданої температурі
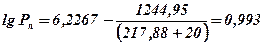

3. Визначаємо фактичну концентрацію насиченої пари етилацетату

Висновок: при заданих умовах тиск насиченої пари етилацетату буде Рп = 9,84 кПа, а концентрація складе jофак = 9,84 %.
Способи припинення та попередження горіння.
Дана тема має на меті підготувати слухачів для вивчення пожежної тактики.
Перед усім необхідно зауважити що загасити пожежу передусім значить припинити процес горіння в усіх видах, тобто створити в зоні горіння умови виключаючі можливість продовження процесу горіння в любій формі (полум’яного горіння безполум’яного гетерогенного горіння тління і т.д.) Аналіз цих умов зручніше вивчати за допомогою методу “від протилежного” тобто аналізу умов необхідних та достатніх для горіння на пожежі, маючи на увазі головним чином дифузійний процес горіння.
Якісно ці умови “необхідні та достатні” можливо представити в вигляді мнемонічної схеми “класичного трикутника пожежі” пальне - окисник – джерело запалювання.
При такій схемі достатньо обірвати один з зв’язків в трикутнику і горіння стає неможливе. Необхідно згадати що існує чотири способи припинення горіння: спосіб охолодження розбавлення ізоляції та хімічного гальмування реакції. На практиці ні один з згаданих видів в чистому вигляді не зустрічається за виключенням хімічного гальмування. При гасінні проходить комплексний вплив вогнегасних засобів на горючу систему. Тим не менше всі вогнегасні засоби прийнято класифікувати на вогнегасні засоби охолоджуючі, розбавляючі, ізолюючі та інгібіюючі.
В якості вогнегасних засобів охолодження використовують засоби з великою питомою теплоємкістю, чи великою теплотою фазового переходу (випаровування), до таких відносяться: вода, розчин води зі змочувачами, вуглекислота в снігоподібному вигляді та водні розчини солей.
Крім того, може бути використано перемішування нагрітих та холодних шарів рідини з високою температурою спалаху. Розбавлення чи флегматизація процесу горіння заснована на явищі зниження швидкості хімічної реакції при зниженні концентрації компонентів горючої суміші що слідує з законів Арреніуса. Температура горіння залежить від концентрації реагуючих речовин і чим сильніше суміші відрізняються від стехіометричного складу, тим більше об’єм не прорегаувавшого надлишкового компоненту реакції vр тим нижча температура горіння.
В якості флегматизуючих вогнегасних засобів використовуються оксид вуглецю, водяна пара азот, та тонко розпилена вода. Введення в зону реакції горіння флегматизатора приводить до звуження концентраційних меж розповсюдження полум’я Нижня межа підіймається а верхня знижується. При деякій кількості флегматизатора що називається мінімальною флегматизуюючою концентрацією верхня та нижня межі розповсюдження полум’я з’єднуються утворюючи точку флегматизації

Рис1. Залежність КМРП від вмісту флегматизатору.
Вивчення особливостей припинення горіння ізолюючими вогнегасними засобами необхідно починати з вивчення механізму впливу як процес горіння. Необхідно врахувати що ізолюються в процесі гасіння як горюча речовина від безпосереднього контакту з окисником так і поверхня матеріалу від впливу теплового факелу в наслідок чого зменшується швидкість підготовчих процесів в горючому матеріалі та вихід продуктів випаровування та термічного розкладу в зону реакції.
Необхідно розглянути класифікацію ізолюючих вогнегасних засобів по їх фізичному стані визначивши які з них можуть бути віднесені до рідких твердих та газоподібним ізолюючим засобам. Найбільш ефективними вогнегасними засобами являються вогнегасні засоби що гальмують швидкість реакції горіння. Речовини що гальмують швидкість хімічної реакції шляхом взаємодії з активними центрами, називаються інгібіторами процесу горіння. Хладони (фреони) – це вуглевод в структурі якого один або декілька атомів заміщенні атомом галогену (фтор, хлор, бром, йод). Попадаючи в зону реакції горіння такі продукти під дією розкладаються з утворенням радикалів типу СН2F’, C2H4Cl’, Br’, CFCL’. В подальшому проходить процес їх взаємодії з активними центрами реакції горіння що призводить до припинення процесу горіння, так як швидкість реакції горіння зменшується нижче критичного значення.
Вогнегасна здатність хладонів в три рази вища чим у газів флегматизаторів. Тим не менше застосування флегматизаторів ускладнено враховуючи їх відносну токсичність, високу корозійну здатність високу вартість. Крім того фреони активно руйнують озоновий шар атмосфери і тому випуск їх та застосування заборонено та знижується.
Вогнегасні порошки загального та спеціального призначення (за виключенням коркоутворюючих та вспучуючихся порошків на основі графіту) мають наряду з іншими раніше розглянутими нами ще й яскраво вираженими інгібіюючими властивостями. Механізм гасіння пожеж вогнегасними порошками більш складний, чим у всіх решта вогнегасних засобів, при цьому в припиненні реакції горіння беруть участь такі механізми як.
1. Охолодження зони горіння вогнегасним порошком за рахунок високої теплоємкості вогнегасної речовини.
2. Розбавлення горючого середовища реакції горіння вогнегасним порошком як інертним флегметизатором.
3. Ізоляція компонентів реакції горіння шляхом створення на поверхні пального ізолюючого шару.
4. Ізоляція горючої речовини від теплової дії факелу шляхом поглинання і та відбивання ппроменевого теплового потоку.
Наряду з перерахованими механізмами активну роль грає інгібіювання процесу горіння радикалами, що утворюються при термічному розкладі молекул порошку. Вогнегасні порошки, в зрівнянні з іншими вогнегасними засобами мають ряд позитивних властивостей та можуть застосовуватись для гасіння металів, металоорганічнх з’єднань, електроустановок під напругою.
При вивченні даного матеріалу необхідно познайомитись з теоретичним розрахунком інтенсивності та витрати. Необхідно врахувати що теоретично - необхідна витрата та інтенсивність є нижчою чим та що приймається при практичних розрахунках при рішенні пожежно-тактичних задач. Теоретичний питома витрата qптиос вогнегасного складу може бути обчислений як.
 (45)
(45)
де qпит= питома кількість тепла поглинута вогнегасним засобом в зоні реакції горіння. Кдж/кг.
 - нижча теплота згорання речовини кДж/кг.
- нижча теплота згорання речовини кДж/кг.
Питома кількість відведеного тепла визначається як:  qрід+qвип+qпар;
qрід+qвип+qпар;
де qрід- питома теплота нагріву до температури кипіння кДж/кг.
qвип- питома теплота пароутворення. КДж/кг.
qпар- питома теплота нагріву пари до температури полум’я. кДж/кг.
Для води qпит. рівне 4400 кДж/кг. Вуглекислоти в вигляді снігу 1553,85 кДж/кг. На практиці інтенсивність подачі вогнегасних засобів визначається за формулою.
 ; (46)
; (46)
де Іг- інтенсивність подачі вогнегасного засобу. л/(см2),кг/(см2);
Sг- площа гасіння. М2
Vос- фактичний питома витрата ВЗ. л. кг. м2.
τг- час гасіння хв.
При визначенні ефективності флегматизаторів визначають їх мінімальну флегматизуючу концентрацію. Концентрація інертного газу в точці флегматизації може бути розрахована по формулі.
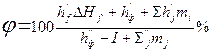 (47)
(47)
де 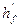 - коефіцієнт теплоти утворення суміші горючих компонентів в газоподібному стані, моль/кДж;
- коефіцієнт теплоти утворення суміші горючих компонентів в газоподібному стані, моль/кДж;
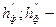 коефіцієнти характеризуючі властивості флегматизаторів;
коефіцієнти характеризуючі властивості флегматизаторів;
 коефіцієнти атомів та структурних груп горючих компонентів, їх значення приведенні в таблиці №;
коефіцієнти атомів та структурних груп горючих компонентів, їх значення приведенні в таблиці №;
 абсолютне значення теплоти утворення горючої речовини кДж/моль.
абсолютне значення теплоти утворення горючої речовини кДж/моль.
Приклад вирішення задачі.
Визначити теоретично необхідний витрату води та мінімальну флегматизуючу концентрацію вуглекислого газу при горінні масляної кислоти СН2О2.
1. Визначаємо основні параметри масляної кислоти по таб.№11 та довіднику Баратова А.Н. ∆Нсг=2177,13 кДж/моль.,  ∆Нf=-535,25 кДж/моль.
∆Нf=-535,25 кДж/моль.
2. Проведемо розрахунок теплоти згорання. Масляної кислоти з кДж/моль в кДж/кг по формулі 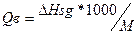 ;
;
для речовин в газоподібному стані при перерахунку з кДж/моль в кДж/м3 та в зворотному напрямку по формулі.  знаючи що молярна маса речовини рівна 88 кг/моль.
знаючи що молярна маса речовини рівна 88 кг/моль.
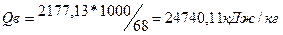
3. Визначаємо питому витрату води для гасіння методом охолодження по формулі

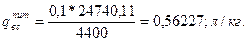
4. Визначаємо мінімальну флегматизуючу концентрацію диоксиду вуглецю по формулі знаючи що mc=4, mh=8, mo=2;
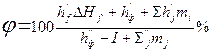

Мінімальна флегматизуюча концентрація φ= 58,8 %.
Оцінка пожежної небезпеки горючих речовин та матеріалів.
При оцінці пожежної небезпеки речовин розрізняют:
1. Гази – речовини абсолютний тиск яких при 50С, рівно чи більше 300 Кпа. Або критична температура яких менше 50С.
2. Рідини – речовини з температурою плавлення (каплепадіння) більше 50С.
3. Пил дисперговані тверді речовини та матеріали з частинками менше 850 мкм.
Таб.1.9 Показники, що характеризують пожежо та вибухонебезпеку речовин та матеріалів.
| Показники | Застосування показників | |||
| Для газів | Для рідин | Для твердих речовин | Для пилу. | |
| Група горючості | + | + | + | + |
| Температура спалаху | -- | + | -- | -- |
| Температура спалахування | -- | + | + | + |
| Температура самоспалахування | + | + | + | + |
| Нижня та верхня межа розповсюдження полум’я | + | + | __ | + |
| Температурні межі розповсюдження полум’я. | -- | + | -- | -- |
| Температура самонагрівання. | -- | -- | + | + |
| Температура тління. | -- | -- | + | + |
| Температурні умови теплового самонагрівання. | -- | -- | + | + |
| Мінімальна енергія запалювання. | + | + | -- | + |
| Кисневий індекс | -- | -- | + | -- |
| Здатність вибухати при взаємодії з водою, киснем, та іншими речовинами. | + | + | + | + |
| Нормальна швидкість розповсюдження полум’я. | + | + | -- | -- |
| Швидкість горіння | - | + | - | - |
| Коефіцієнт димоутворення. | -- | -- | + | -- |
| Індекс розповсюдження | -- | -- | + | -- |
| Показники токсичності горіння полімерних матеріалів | -- | -- | + | -- |
| Мінімальний вибухонебезпечний вміст кисню. | + | + | -- | + |
| Мінімальна флегматизуюча концентрація флегматизатора. | + | + | -- | + |
| Максимальний тиск вибуху. | + | + | -- | + |
| Швидкість зростання тиску при вибуху. | + | + | -- | + |
| Примітка. Знак (+) означає застосування, знак (-) незастосування показника. |
Табл. 2.1 Основні показники пожежної небезпеки речовин та матеріалів.
Дата публикования: 2015-09-18; Прочитано: 1199 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
