 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теплота утворення речовин 2 страница
|
|
R-CH2-CH2-R+ -O-О-- R-CH2-CH2-R
О О
Потім проходить розрив одного з валентних зв’язків з утворенням безпосередньо перекисів з характерною групою (-О-О-) R-CН2-О-О-СН2-R
Перекиси-речовини, які мають характерну для цього класу речовин групу, R-О-О-R. Енергія розриву зв’язку (-О-О-) у всіх видах перекисів досить низька і складає 150-160 КДж/моль, тому всі перекиси реакційно здатні і нестійкі речовини, які при незначній температурній дії розкладаються з утворенням оксидних, гідроксильних і вуглеводневих радикалів:
OH*
ROOH Ro* 167 кДж
ROOH + ROOH RO* + H2O + RO2* - 54, 5 кДж
Радикали які утворюються при розпаді являються активними центрами реакції окислення і ініціюють продовження процесу окислення до утворення кінцевих продуктів реакції горіння.
Виникаючі вільні радикали реагують з вуглеводами, відриваючи від них атоми водню і генеруючи нові вільні радикали. Такий процес приводить до прискорення процесу окислення горючої речовини, так як енергетичні затрати при окисленні перекисами набагато нижче, ніж при окисленні молекулярним киснем.
Види і небезпека перекисів.
Взагалі перекиси будь яких речовин можна розглядати як похідні від перекису
водню.
Н+ -О-О- = Н -О-О- Н перекис водню
в яких один або обидва атоми водню замінені на радикали органічної речовини. В залежності від отриманої структури утворюються наступні види перекисів.
Перекис R-O-O-R
Гідро перекис R-O-O-Н
Оксигідроперекис R-СН-O-O-Н
ОН
Окси перекис R-СН-O-O-R
ОН
Органічні перекиси
гідроперекис метилу СН2О2(СН3-О-О-Н)
гідроперекис метилу С2Н6О2(С2Н5-О-О-Н)
перекис ацетону С3Н6О3
в чистому вигляді представляють велику пожежну небезпеку, їх небезпека полягає в наступному:
1. Вони є сильними окисниками.
С4НОО + 12 Н2О2 = 4СО2 + 17 Н2О - Н кДж/моль
2. Органічні перекиси легко займаються від малопотужних джерел запалювання та згоряють з великою швидкістю.
3. Вони чутливі до тертя, удару чи нагріву. Розкладаються з вибухом.
4. Нестабільні у процесі зберігання. Можуть розкладатися при нормальній температурі, швидкість розкладання залежить від сторонніх домі шків.
Над вивченням властивостей перекисів працювали Н.Д. Зелінській, Л.В. Пісаржевський, С.С. Келятін, С.С. Медведьев та багато інших відомих хіміків. У нас в Харкові працює центр по вивченню якостей перекисів та використанню їх в хімічній промисловості НІІОХім.
В результаті, багатьох досліджень був вирішений ряд практичних задач пов’язаних з розвитком науки і техніки. Власне інтенсифікація згорання рідкого палива в рідинних реактивних двигунах за рахунок використання перекису в якості каталізаторів хімічних реакцій.
В теперішній час дослідами доказано, що окислення вуглеводів супроводжується утворенням перекису однак деякі явища виявлені при окисленні ряду речовин таких як елементоорганічні зєднання і неорганічні речовини важко доводимі з точки зору пере окисної теорії. Не знаходять пояснення такі явища, як само прискорення реакцій при самозайманні, а також при дії каталізаторів.
Перекисна теорія розвитку не відповідає на питання процесу окислення та горіння, але тим не дивлячись на це дала поступ у вивченні цих процесів і в цьому заслуга даної теорії.
Основи теорії ланцюгових хімічних реакцій Н.Н. Семенова
Поняття та види ланцюгових реакцій.
Багато явищ протікаючих при окисленні цілого ряду речовин в присутності кисню, хлору, фтору, брому та інших окисникив не можна пояснити за допомогою перекисної теорії. Подібне окислення дістало пояснення тільки завдяки теорії ланцюгових реакцій яку розробив Н.Н. Семенов.
Перші уявлення про ланцюговий механізм протікання хімічної реакції дав німецький фізик Боденштейн. Детальнішою розробкою теорії ланцюгових реакцій з 1927 року зайнявся Н.Н. Семенов, яка була кінцево сформована на початку 50-х років. Ця теорія отримала світове визнання і в 1954 році Н.Н. Семенов був нагороджений Нобелівською премією – присуджену за визначні наукові досягнення.
Сутність ланцюгової теорії окислення заключається в тому, що першопочатково взяті речовини (горючі та окисник) переходять в кінцеві продукти через утворення активних центрів по ланцюговому механізму. Схематично даний процес можна уявити в наступному вигляді:
Гор. реч + Ок → активн. центр ланцюгова реакція → продукти горіння.
Основні положення теорії ланцюгових реакцій такі – джерело запалювання у вигляді теплового або променевого імпульсу, електричного розряду, опромінення або радіоактивного розпаду приводить до підвищення кінетичної енергії молекул горючого або окисника, ьак як кисень чи горюча речовина в зичайному стані взаємодіяти не можуть. При цьому кінетична енергія руху і ударів переходить в потенціальну енергію речовини і може витрачатися на порушення хімічних зв’язків в молекулі. Хімічні зв’язки руйнуються тільки в тому випадку, коли запас потенціальної енергії перевищує енергію активності Еакт.
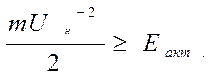
де m – приведена маса молекул, кг;
Uн – середня теплова швидкість молекул, м/с.
Активні центри це частки які володіють великим запасом енергії, що зумовлює їх високу реакційну здатність.
Активними центрами можуть бути окремі атоми ( О*, СІ*, F*, та інші), вільні радикали (СН3*, С2Н5*)функціональні групи (-ОН*, -NO2*, -СООН*) та інші. Побічні продукти реакцій горіння також являються активними центрами і можуть стати початком або продовженням ланцюга.
Особливо багато активних центрів утворюється при електричному розряді. При дії електричного розряду на пари бензолу утворюються такі радикали, як (С6Н4*, С6Н2*, С6*, С5Н3*, СН2*, СН*,). Ці радикали відіграють роль активних центрів ланцюгової реакції при спалахуванні парів електричним розрядом.При взаємодії водню та хлору процес проходить за наступним сценарієм.
Під впливом світла Хлор утворює два активні центри що взаємодіють з атомом водню з отриманням молекули НСІ (кінцевий продукт реакції) і нового активного центру у виді атома водню, який в свою чергу вступить в реакцію з молекулою хлору, і знову утвориться одна молекула НСІ і активний центр у виді атома хлору.
Сl2 + F =2Cl*
Н2 + Cl* = НCІ +Н*
Сl2 + Н* = НCІ + Cl*
Cl* + Н*= НCІ
В результаті взаємодії реагуючих компонентів весь час буде утворюватись одна молекула кінцевого продукту і один активний центр здатний продовжувати реакцію. Така ланцюгова реакція називається нерозгалуженою.
Якщо в результаті акту хімічної взаємодії утворюються два або більше активних центрів, один з яких продовжує хімічну реакцію, а інші дають побічні продукти, то така ланцюгова реакція називається розгалудженою.
Одним із прикладів розгалудженої ланцюгової реакції може служити реакція взаємодії водню і кисню.
Н2 + О* = ОН* + Н*
Н2 + ОН* = Н2О + Н*
О2 + Н*= ОН* + O*
При взаємодії молекул водню з активним киснем утвориться два активних центри, в подальшому обидва ввійдуть в взаємодію з атомами з утворенням декількох нових центрів реакції. Ланцюгова реакція буде отримувати нові розгалуження, в яких даний процес буде повторюватись. Причинами обриву ланцюгу в об’ємі суміші являються:
1. Побічна реакція активного центру з домішками що є в суміші
2. Розсіювання активною молекулою енергії при зіткненні з іншими неактивними чи однорідними молекулами.
3. Обрив ланцюга на стінках реакційної посудини (проходить внаслідок адсорбції активних центрів поверхнею стінки.)
Ланцюгова теорія приписує вирішальну роль в окисленні вуглеводів вільним радикалам та атомам. Ця теорія не заперечує перекисної теорії окислення вуглеводів, вона лише доповнює та розвиває її. Ланцюгова теорія передбачає що окислення вуглеводів може протікати по ланцюговій реакції, коли в процесі окислення важкоокислюваної речовини здатні легко окислятись, та являються індукторами для окислення вихідної речовини.
Академік Семенов вважає, що активними центрами в реакції окислення можуть бути частинки СL, H, OH, SO,.. вільні радикали СН, СН2, СН3,. та інш. Окислення метану за наявністю радикалу СН2, (що утворюється при реакції типу СН4+О2=СН2+Н2О) може протікати за наступною схемою.
1. СН2+О2=НСОН+О 3. СН2+О2=СН2О2
2. О+СН4=СН2+Н2О 4. СН2О2+СН4=НСОН + Н2О+СН2
Як видно дана схема окислення метану відповідає перекісній теорії окислення. В ній первинними продуктами окислення метану являється перекис СН2О котра розкладаючись, окислює метан. Відмінністю даної схеми являється те що вона показує механізм виникнення активного центру СН2, окислення якого веде до утворення перекису. Таким чином ланцюгова теорія доповнює перекисну показуючи кінетичну сторону явища, пояснюючи причину самоприскорення процесу та уточнює ймовірні шляхи активації реагуючих речовин.
Принципової різниці між розгалуженнями немає, але якісно вони відрізняють ся тим, що при безперервних умовах окислення в розгалужених ланцюгах проходить ріст швидкості реакції по геометричній прогресії.
Умови протікання ланцюгових реакцій.
При молекулярному русі активні центри можуть зіштовхуватися з молекулами горючої речовини, молекулами інертних продуктів, які знаходяться в горючій системі, молекулами продуктів горіння, взаємодіяти між собою або зіштовхуватися з поверхнями. При зіштовхуванні з молекулами горючого або окисника можуть протікати хімічні перетворення з утворенням продуктів реакції і нових активних центрів.
Число активних зіткнень, які ведуть до продовження реакції, можна визначити на основі закону розподілу енергії Максвела – Больцмана:
Z = UнGjаnjвm
де jаnjвm – концентрації компонентів реакції;
G – розріз зіткнення молекул.
Переріз ефективного зіткнення молекул визначається як:
G= p(ra+rb)2
де ra, rb –радіуси молекул та активних центрів реакції.Схема активних співстикань 
Але протікання будь якої ланцюгової реакції зв’язано не тільки з утворенням нових активних центрів, але і з їх загибеллю.
Загибель активних центрів може проходити при фізичній взаємодії з стінками посудини або з інертними компонентами суміші, при зіткненні з продуктами реакції. Загибель може проходити при взаємодії з речовинами які не дають нових активних центрів, тоді проходить хімічне гальмування реакції – на цьому принципі і заснований один із методів припинення горіння.
Швидкість протікання ланцюгової реакції визначається швидкістю початкового ініціювання молекул (-W0), швидкостями розгалуження (Wf = F*n) і обриву (Wg = G*n) ланцюгів. Загальна швидкість утворення активних центрів реакції рівна сумі всіх трьох швидкостей.

де n – концентрація активних центрів реакції;
F,G – константи швидкостей реакції розгалуження і обриву ланцюгів.
1. Якщо швидкість утворення активних центрів реакції більша, ніж швидкість обриву ланцюгів, реакція йде з прискоренням. Таке положення характерне для виникнення процесу горіння або вибуху.
F > G 
2. Якщо швидкість утворення активних центрів реакції менша, ніж швидкість обриву ланцюгів, реакція йде з гальмуванням хімічної реакції і припиненням горіння.
F > G 
Активним центрам присутня схильність до взаємодії між собою з утворенням малоактивних продуктів і розривом ланцюга. Розрив ланцюга проходить і при зіткненні їх з інертними продуктами реакції, інертними газоподібними і твердими речовинами. На цій властивості засновано гасіння пожеж вогнегасними порошками і хладонами. При попаданні проходить наступне: хладон при високій температурі розкладається з утворенням своїх активних центрів F*, CI*, Br*, J*, які з великою швидкістю взаємодіють з активними центрами горіння. В результаті утворюються мало реакційні продукти реакції.
C2F4Br2 = C2F4Br* + Br*
H* + Br* = HBr
H* + C2F4Br* = C2HF4Br*
Слова Н.Н. Семенова підкреслюють що теорія ланцюгової реакції окислення являється “логічним розвитком класичної теорії окислення ”, в наступному вона отримала новий розвиток в подальших працях колективу вчених під керівництвом Н.Н. Семенова і Я.Б. Зельдовича і має велике прикладне значення в науці і техніці, в тому числі і в пожежогасінні.
3. Основні поняття матеріального балансу процесу горіння.
Визначення матеріального балансу.
При горінні речовин і матеріалів в умові пожежі, незважаючи на всю удавану хаотичність протікання процесів строго дотримуються закони збереження матерії. При розгляді різних аспектів процесу горіння важливу роль відіграє матеріальний баланс між вихідними матеріалами горіння і продуктами реакції горіння. Вигоряння горючого матеріалу й окисника можна представити як постійний перехід вихідних речовин у продукти повного і неповного згоряння. 
Раніше ми вже говорили, що для початкової стадії пожежі характерним є режим дифузійного гомогенного горіння, при цьому горіння підтримується за рахунок постійного переходу горючого матеріалу з будь-якого агрегатного стану: рідкого чи твердого в пароподібний стан.Під матеріальним балансом реакції горіння будемо розуміти співідношення між кількістю речовин, що вступають у реакцію, і кількістю речовин – продуктів реакції, обумовлене на підставі рівняння реакціїі інформації про хімічний склад і фізичний склад речовин.Дотримання умов матеріального балансу позначає, що загальна маса компонентів реакції залишається незмінною У такий спосіб можна записати:

Безпосередньо в реакції беруть участь пальне й окислювач, однак при горінні можуть “бути присутнім ” також інші речовини, що можуть як прискорювати хід реакції (каталізатором), так і сповільнювати його (флегматизатори). Крім того, звичайно в процесі горіння присутні нейтральні речовини – азот, аргон і диоксид вуглецю й інші. Тоді в повному вигляді умова балансу записується:
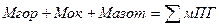
Строго кажучи, не існує абсолютно нейтральних речовин, хоча б з тієї причини, що будь-яка речовина має кінцеву теплоємність і теплопровідність, тому частина теплової енергії, що виділяється при реакції, йде на нагрівання нейтральної добавки.
Класифікація продуктів горіння.
У результаті реакції утворяться продукти горіння. Під продуктами горіння будемо розуміти газоподібні, тверді і рідкі речовини, що утворяться при взаємодії окисника з пальним у процесі горіння.
В умовах пожежі найчастіше горять органічні речовини: деревина, тканини, нафтопродукти і т.д., до складу яких головним чином входять вуглець, кисень, водень і азот.
До продуктів горіння також відносять нейтральні добавки, що є в суміші як до реакції, так і після її, і ту частину горючого й окисника, що не приймала участі в реакції.
Продукти горіння можна класифікувати: По агрегатному стану. Газоподібні Рідкі Тверді.У продуктах горіння речовини можуть знаходитися в газоподібному, рідкому і твердому стані. Приведемо деякі приклади продуктів горіння що знаходяться в різних агрегатних станах. До газоподібного відносяться вуглекислий газ, оксид вуглецю, хлороводень, ціаністий водень і т.д. НС HCN. Прикладом рідкого горіння є вода, сірчана кислота, соляна кислота, карбонові кислоти й ін. H2O H2 SO4 HCL. У твердому агрегатному стані знаходяться такі продукти горіння, як оксиди металів Nа2O, Ca, AL2O3, P2O5. Продукти горіння можуть бути класифіковані в наступний спосіб - по повноті згоряння.
У залежності від умов протікання процесу горіння, зв'язаному з особливостями надходження повітря в зону реакції горіння всі продукти можна підрозділити на продукти повного і неповного згоряння. Продукти повного згоряння це не хімічні компоненти, що утворяться при повному окислюванні речовини киснем (H2O CO2 HCL N2 SO2 Si2).
У записі рівняння реакції горіння ми будемо умовно вважати, що при згорянні утворяться тільки продукти повного згоряння. Але насправді на пожежі всі набагато складніше і на пожежі, навіть при досить сильному повітрообміні можуть утворюватися і продукти неповного згоряння, що ми бачимо у виді диму (CO, C2H4, H2, C6H6, C 2H 2, CH 2O2,). По хімічному складу. Розглядаючи хімічний склад продуктів можна замінити,що він дуже різноманітний, у продуктах горіння присутні як неорганічні прості з'єднання, так і складні органічні продукти. Так наприклад, зовсім недавно відбулася велика пожежа в центрі Москви на заводі резино-технічних виробів, де через сильне задимлення була проведена евакуація хворих і породілей із прилеглих лікарень і проведені підготовчі заходи щодо евакуації населення найближчих кварталів. Продукти горіння можна поділити на:
- хімічно інертні і
- та реакційно здатні.
Хімічно інертні речовини це звичайно кінцеві продукти реакції горіння нездатні до подальших перетворень у нормальних чи умовах умовах пожежі.
Реакційно здатні компоненти можуть вступати в хімічні реакції в цих умовах.
Реакційно здатні речовини більш небезпечні, але не варто думати, що хімічно стійка речовина типу Синильної кислоти, Фозгена чи Двоокису сірки менш небезпечні для людей, що потрапили в зону чи задимлення особового складу пожежної охорони, що займаються гасінням пожежі.
Необхідно запам'ятати, що практично всі речовини, що виділяються в продуктах горіння є біологічно небезпечними продуктами.
Дим і його фізико-хімічні властивості.
Димом буде називатися дисперсну систему, що складається з твердих і рідких часток (дисперсної фрази) зважених у дисперсійному газовому середовищі. Розміри твердих чи рідких часток диму коливаються від 10-8 до 10-5м.
Розміри часток близькі один по одному величини до довжини вільного пробігу молекул, тому частки “беруть участь” у Броуновском русі. Що обумовлює кінетичну стійкість диму. Крім того, частки несуть на собі однойменний електричний заряд, у наслідку цього відштовхуються друг від друга, що обумовлює стійкість диму.
Дим становить велику небезпеку по наступним причинах:
- висока температура;
- токсичність продуктів горіння;
- непрозорість диму, що знижує видимість і утрудняє евакуація людей і дій особового складу по гасінню пожежі;
- можливість утворення продуктами термоокисного розкладання і неповного згоряння вибухонебезпечних сумішей своздухом.
Дим, щоутвориться в процесі горіння на пожежі характеризується своїми фізичними і хімічними властивостями.
Фізичні параметри диму:
1. Концентрація диму: це кількість продуктів горіння що містяться в одиниці обєму. У зоні задимлення концентрація продуктів горіння коливається від 1 10-4 –4 до 1 10-6-6 кг/м3
2. Щільність задимлення. Щільність задимлення визначається по проникності лучачи переносного пожежного ліхтаря і виходячи з цього може бути:
- сильної, при видимості до 3 метрів;
- середньої, при видимості від 3 до 6 метрів;
- слабкої, при видимості від 6 до 12 метрів.
3. Вміст кисню в повітрі. Зниження концентрації кисню нижче 21% приводить до кисневого голодування особового складу, що беруть участь у гасінні пожежі, а при зниженні концентрації нижче 16% робота особового складу без індивідуальних засобів захисту неможлива. З цією метою в пожежній охороні організована газодимозахистна служба, а особовий склад використовує захистні протигази.
4. Температура продуктів горіння. Температура продуктів горіння безпосередньо в місця горіння досягає 10000С., але в приміщеннях температура диму може бути істотно нижче, усі залежить від умов воздухо- і газообміну. Головним фактором, що впливає на температуру диму є коефіцієнтом надлишку повітря, з його збільшенням температура продуктів горіння знижується. Проте небезпечною температурою є температура 50-600С, робота особового складу при такій температурі зв'язана ризиком для життя через перегрів організму.
5. Токсичність продуктів згоряння – це здатність продуктів згоряння викликає отруєння людей без засобів спеціального захисту.
Токсичність продуктів горіння залежить від хімічного складу горючого матеріалу. Горіння элементоорганічних матеріалів супроводжується виділенням продуктів утримуючих ці елементи. Так при горінні галогеновмістих полімерів виділяються окисли азоту, акролеїн, синильна кислота; ті які містять сірку – сірководень, сірчистий газ, сірчиста і сірчана кислоти.
В умовах пожежі людина піддається складному впливу продуктів повного і неповного горіння і продуктів їхньої хімічної взаємодії з між собою й вогнегасними речовинами. Під впливом високих температур речовини розкладаються, утворючи при цьому твердий-коксовий осад а рідкі і газоподібні речовини одержали назву “летучих”.
Кінцеві продукти розпаду мономерів – прості речовини. Для поліетилену, наприклад, це буде вуглець і водень, для капрону – вуглець, водень, кисень і азот. Однак такий розпад можливий лише при досить високих температурах – вище 30000С. На пожежі ж горючі речовини нагріваються до температури, що не перевищує 15000С, тому в результаті утворяться як прості так і складні речовини.
Молекули з відносно невеликою молекулярною масою розкладаються на газоподібні речовини – C2H6 H2 CO C2H4 CH4 CO2 O2 HCN
Найбільш небезпечним є комплексний вплив продуктів згоряння
на організм людини. Особливо небезпечні продукти можуть виходити в ході хімічні реакції між компонентами димогазової суміші, так при з'єднанні двоокису сірки з водою утвориться сірчиста і сірчана кислота, а при реакції окислів азоту, азотна кислота. Тому в практиці гасіння пожеж досить часто зустрічаються приклади одержанні сильних хімічних опіків особового складу.
Продукти неповного згоряння, що утворяться при горінні речовин і матеріалів у закритих приміщеннях при надходженні свіжого повітря утворять вибухонебезпечні суміші, що спалахують від наявних джерел запалювання. Суміш, що утворилася, горить у кінетичному режимі, тобто вибухове горіння.
Існує кілька способів боротьби з димом, що знижує його небезпеки один з них - використання разпиленних струменів води, при цьому знижується температура диму, збільшується його вологість, відбувається нейтралізація заряджених часток, їхнє злипання й осадження.
Коефіцієнт надлишку повітря. Основні поняття матеріального балансу.
Розглянемо спочатку загальний випадок горіння на пожежі. У загальному виді реакція горіння записується:
Гор. Р + 
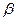 (О2+3,76N2)=
(О2+3,76N2)=
У випадку, коли пальне має складний хімічний склад, необхідно розглядати окремо горіння кожного елемента.
Для характеристики ступеня забезпеченості повітря вводиться поняття коефіцієнта надлишку повітря ( в), що показує, у скількох разів кількості, що надходять у зону горіння, перевищує необхідне для згоряння одного кмоля горючого:
в), що показує, у скількох разів кількості, що надходять у зону горіння, перевищує необхідне для згоряння одного кмоля горючого:
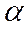 У=
У= 

де: V0в об’єм повітря, необхідний для згоряння одного кМоля горючого

Vв об’єм повітря, що надходить у зону реакції в дійсності при згоранні одного кМоля горючого.
Звичайно до моменту закінчення пожежі зміст кисню в суміші близько 14%, тому коефіцієнт надлишку повітря практично завжди більше. Незважаючи на те, що в зону реакції горіння надходить повітря з надлишком, дифузійне горіння протікає з утворенням продуктів неповного згоряння.
Коефіцієнт надлишку повітря можна визначити як відношення процентного вмісту кисню в повітрі до процентного вмісту його в продуктах горіння.
ВИСНОВОК: У процесі горіння на пожежі речовини вступають у реакцію у визначених співвідношеннях. У результаті реакції виходять продукти горіння, що можуть знаходитися в різному агрегатному стані. Конкретний вид продуктів горіння залежить від умов реакції і виду реагуючих речовин.
Матеріальний баланс процесу горіння при горінні хімічно чистої речовини.
Питомий і повний об’єм повітря необхідний для повного згорання речовин.
Речовини і матеріалии, що мають хімічну формулу прийнято називати індивідуальними.
До індивідуального можна віднести: СН4 С2H2 C6H6 C10H10
Для хімічно чистої речовини рівняння реакції має вид:
З рівняння реакції безпосередньо випливає, що для згоряння одного кМоля горючого потрібно 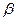 кМолей кисню і, отже, кМолей повітря. Об’єм повітря, необхідний для згоряння одиниці кількості (одного кМоля. кг. м3) хімічно чисті горючі речовини називається питомим теоретичним об’ємом повітря і позначається VB.
кМолей кисню і, отже, кМолей повітря. Об’єм повітря, необхідний для згоряння одиниці кількості (одного кМоля. кг. м3) хімічно чисті горючі речовини називається питомим теоретичним об’ємом повітря і позначається VB.
Незалежно від агрегатного стану речовини його можна визначити для згоряння одного кмоля з рівняння реакцій горіння.
Нехай пальне – газ. Причому і пальне, і окислювач знаходяться в однакових умовах (Р и Т)
Тоді рівняння стану для них можна записати в такий спосіб:



Де: 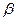 - стехіометричний коефіцієнт у рівнянні реакції горіння;
- стехіометричний коефіцієнт у рівнянні реакції горіння;
ок- окислювач;
гв - пальне;
м - кількість молів відповідного речовини;
R- газова постійна.
Отже питомий питомий об’єм повітря теоретично необхідний для повного згоряння 1 кмоля речовини можна визначити як:
 -питомий обєм повітря -необхідний для згорання одного кіломоля горючої речовини
-питомий обєм повітря -необхідний для згорання одного кіломоля горючої речовини
 -практичний обєм повітря - необхідний для згорання любої кількості горючої речовини.
-практичний обєм повітря - необхідний для згорання любої кількості горючої речовини.
де: VГВ кількість горючої речовини, кМоль.
Якщо об’єм горючого виразити в кубічних метрах, то можна вивести формулу для визначення теоретично необхідного об’єму повітря при горінні газоподібних продуктів з таких міркувань:
При горінні одного кубометра горючого газу (питомий теоретичний об’єм)
Vpov=4.76*B
При горінні будь-якої кількості газу (повний теоретичний об’єм)
Дата публикования: 2015-09-18; Прочитано: 758 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
