 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теплота утворення речовин 4 страница
|
|
Теплотою згорання називається кількість тепла, що виділяється при згорянні одиниці маси речовини з утворенням продуктів повного згорання. Залежно від способу вираження маси речовини розрізняють стандартну Q кДж / моль (молярну), масову Q’ кДж / кг та об’ємну Q’’ кДж/м3 теплоту згорання речовини.
Розрізняють вищу та нижчу теплоти згорання речовини.
Вища теплота згорання Qв визначається при умові, якщо водень що міститься в речовині згорає з утворенням води в стані рідини, тобто прихована теплота пароутворення була відведена.
Нижча теплота згорання Qн визначається при умові, що водень згорає з утворенням води що знаходиться в продуктах горіння у вигляді пари.
Стандартну (молярну), теплоту згорання розраховують згідно з законом Гесса. Тепловий ефект реакції визначається як різниця теплоти утворення кінцевих та початкових компонентів системи Враховуючи, що теплота утворення простих речовин рівна нулю, математичне вираження закону Гесса для реакції горіння можна записати у наступному виді
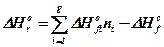 , кДж / моль, (15)
, кДж / моль, (15)
де D Н оr - стандартна теплота хімічної реакції згорання, кДж / моль;
DН оf - стандартна теплота утворення горючої речовини, кДж / моль;
DН оf i - стандартна теплота утворення i-го компоненту продуктів горіння, кДж / моль;
ni - кількість молів i-го продукту горіння у рівнянні реакції горіння.
Реакції горіння ідуть з виділенням тепла, тому знак "-" опускається, і формула для визначення молярної теплоти згорання має вигляд.
 , кДж / моль,
, кДж / моль,
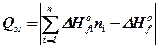 , кДж / моль, (16)
, кДж / моль, (16)
Для перерахування молярної теплоти згорання Q у масову Q’ можна використати формулу
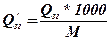 , кДж / кг, (17)
, кДж / кг, (17)
Для речовин у газоподібному стані при перерахуванні з стандартної теплоти згорання Q у об’ємну Q’’ використовують формулу
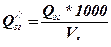 , кДж/м3. (18)
, кДж/м3. (18)
Теплота утворення та тепловміст деяких речовин, що можуть бути присутні у продуктах горіння наведена у таблиці № 4 додатку.
Приклад розв'язування задачі
Задача 5
Визначити вищу на нижню, масову та об’ємну теплоту згорання етилформіату C3H6O2, якщо теплота його утворення рівна D Н of = -371.2 кДж / моль.
1. Складаємо рівняння реакції горіння етилформіату
C3H6O2 + 3.5 O2 = 3CO2 + 3H2O - D Н or
2. На підставі закону Гессу визначаємо молярну вищу на низчу теплоту горіння етилформіату, значення теплоти утворення продуктів горіння (диоксиду вуглецю та води в стані «рідина» та «пара») приймаємо по таб. 4 додатків.
Qв=ï3* (-393.79) +3* (-285.838) - (-371.2) ï = 1098.008, кДж / моль.
Qн=ï3* (-393.79) +3* ( - 241.84) - (-371.2) ï = 1055.01, кДж / моль
3. Визначаємо молярну масу етил форміату.
M = 3 *12 + 6 *1 + 2* 16 = 74 кг/кмоль.
4. Проводимо перерахування молярної теплоти згорання етилформіату, до масової.
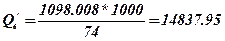 , кДж / кг.
, кДж / кг.
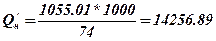 , кДж / кг.
, кДж / кг.
5. Проводимо перерахування молярної теплоти згорання етилформіату в об’ємну
 , кДж/м3.
, кДж/м3.
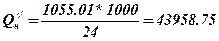 , кДж/м3.
, кДж/м3.
Висновок: вища молярна теплота згорання етилформіату Qв = 1098.008 кДж / моль, Qн = 1055.01 кДж / моль вища масова теплота згорання Q’в = 14837.95 кДж / кг, Q’/н =14256.89 кДж / кг та вища об’ємна теплота згорання Q ‘’в =45750.33 кДж/м3, Q ‘’н=43958.75 кДж/м3
ТЕПЛОТА УТВОРЕННЯ РЕЧОВИН
Теплота утворення речовин визначається по довідникам або розраховується по аддитивним вмістам різноманітних зв'язків.
Стандартна теплота утворення речовини у газоподібному стані визначається як сума аддитивних вмістів D (DHоf) усіх зв'язків між атомами даного з'єднання
DHоf = SD(DHоf) i* ni, кДж / моль, (19 )
де ni - число зв'язків i - го типу у молекулі;
D(DHоf) - аддитивний вміст зв'язку i - го типу, кДж / моль.
Значення адитивних вмістів для різноманітних зв'язків приймаються виходячи з їхнього виду по таблиці 4 додатку.
Стандартна теплота утворення розраховується в наступному порядку:
1. Виписується структурна формула речовини з позначенням видів хімічних зв'язків;
2. Виходячи з структурної формули визначається тип та число зв'язків і аддитивні вмісти D(DHоf) цих зв'язків до теплоти утворення речовини;
3. Визначається теплота утворення речовини DHоf.
Приклад розв'язування задачі
Задача 6
Розрахувати теплоту утворення етилформіату C3H6O2.
1. Структурна формула етилформіат має вид:
СН3 -CH2 -О-СН(=О);
2. Визначаємо тип, кількість зв'язків і аддитивний вміст D (DHоf) цих зв'язків до теплоти утворення речовини:
Тип зв'язку Кількість Вміст D (DHоf), кДж / моль
С - С 1 19.645;
С - Н 6 -19.703;
C - O 2 -49.866;
*С = O 1 -81.142;
3. Визначаємо теплоту утворення етилформіату:
DH оf = 19.645*1-19.703*(6-49.866 *2)(-81.142*1) =-279,447 кДж / моль.
Висновок: стандартна теплота утворення етилформіату у газоподібному стані становить DH оf = -279,447 кДж / моль.
6. Температура горіння речовин
Енергія, що виділяється у зоні горіння витрачається на підготовку горючої речовини, на нагрівання продуктів горіння та на навколишнього середовища тепловим випромінюванням від факелу.
При відсутності теплообміну між системою і навколишнім середовищем (адіабатичні умови), все тепло витрачається на нагрівання продуктів горіння, а загальний тепловміст системи (ентальпія) залишається постійною. Температура, до якої нагріваються продукти горіння, називається температурою горіння, в загальному, вигляді вона визначається як.
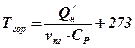 , К (20)
, К (20)
де Q’ н - нижча теплота згорання, кДж / кг;
vпг - об’єм продуктів горіння, м3/кг;
Ср - середнєоб’ємний тепловміст продуктів горіння, кДж/(кг К);
Тгор - температура горіння, К.
Розрізняють калориметричну, теоретичну, адіабатичну і практичну температуру горіння. Вид температури горіння залежить від умов та визначається:
Температура горіння
| Калориметрична | Теоретична | Адіабатична | Практична |
| Ткал | Ттеор | Тад | Тпракт |
| Qпг = Qн | Qпг= Qн - Qдіс | Qпг= Qн | Qпг=Qн - Qпот |
| aп=1 | aп=1 | aп³ 1 | aп¹ 1 |
| Тпоч=273 К | Тпоч=273 К | Тпоч=273 К | Тпоч¹ 273 К |
| Рпоч=101.3 кПа | Рпоч=101.3 кПа | Рпоч=101.3 кПа | Рпоч¹101.3 кПа |
7. Визначення температури горіння з використанням энтальпії
продуктів горіння.
Розрахунок температури горіння для речовин індивідуального та складного складу має деякі відзнаки, але у цілому методика однакова.
1. Визначається дійсне число молів продуктів горіння uпг з врахуванням надлишку повітря
1.1. Складається рівняння реакції горіння
1.2. Визначається теоретичне число молів повітря uоп та теоретичне число молів продуктів горіння uопг
1.3. Визначається дійсне число молів продуктів горіння uпг з урахуванням надлишку повітря;
2. Визначається нижча теплота згорання речовини з закону Гесса або по довідковим даним;
3. Визначається середня ентальпія продуктів згорання H ср
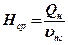 , кДж / моль; (21)
, кДж / моль; (21)
4. Орієнтуючись на ентальпію азоту, визначається температура горіння Т1 у першому наближенні з використанням даних тепловмісту продуктів горіння при різних температурах, таблиця № 1 додатку;
5. Визначається тепловміст продуктів горіння Qпг1 при температурі горіння Т1
Qпг 1=SHi n пгi , кДж / моль; (22)
6. Визначається температура горіння, в другому наближенні виходячи з того, що друге значення Т2 повинно бути менше, якщо теплота згорання більше тепловмісту продуктів горіння або більше, якщо теплота згорання менш тепловмісту продуктів горіння;
7. Визначається тепловміст продуктів горіння Qпг 2 при температурі горіння Т2
Qпг 2=SHi n пгi , кДж / моль;
8. Визначається температура горіння методом лінійної інтерполяції
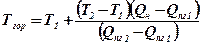 , К; (23)
, К; (23)
Приклад розв'язування задач
Задача 8
Визначити адіабатичну температуру горіння етиленгліколю (C2H6O2 ), якщо теплота його утворення рівна D Н of = -453.8 кДж / моль, а горіння здійснювалось з надлишком повітря a п = 1.3.
1. Визначаємо дійсне число молів продуктів горіння uпг з урахуванням надлишку повітря.
1.1. Складаємо рівняння реакції горіння
C2H6O2+ 2.5 (O2+3.76 N2)=2CO2+3H2O+ 2.5* 3,76 N2 -D H оr ;
1.2. Визначаємо теоретичне число молів повітря uоп та теоретичне число молів продуктів горіння uопг
uоп = 4.76b = 4.76* 2.5 = 11.9 моль/моль;
uопг = uопг = Snпгі = 2 + 3+ 2.5* 3.76 = 14.4 моль/моль.
1.3. Визначаємо дійсне число молів продуктів горіння uпг з урахуванням надлишку повітря
uпг = uопг + (aп - 1) uоп = 14.4 + (1.8-1)* 11.9 =23.9, моль/моль.
2. Визначаємо нижню молярну теплоту згорання речовини з закону Гесса.
Qн=ï2* (-393.79) +3* ( - 241.84) - (-453.8) ï = 1059.3, кДж / моль
3. Визначаємо середню ентальпію продуктів згорання
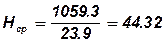 , кДж / моль;
, кДж / моль;
4. Орієнтуючись на ентальпію азоту, визначаємо температуру горіння Т1 у першому наближенні, Т1 = 1400 К.
5. Визначаємо тепловміст продуктів горіння Qпг1 при температурі горіння Т1
Qпг1 = 2*65.19+3*53.77+2.5*3.76*43.61+ (1.3-1) *2.5*4.76* 44.00= 858.704., кДж / моль;
6. Визначаємо температура горіння у другому наближенні. Виходячи з того, що тепловміст продуктів горіння при температурі Т1 =1400 К виявилося нижче нижньої теплоти згорання приймаємо Т2 рівним 1600 К.
7. Визначаємо тепловміст продуктів горіння Qпг2 при температурі горіння Т2
Qпг2=2*76.87+ 3*62.97+ 2.5* 3.76* 50.58+ (1.3-1) * 2.5* 4.76* 51.05= 1000.35, кДж / моль;
8. Визначаємо температура горіння методом лінійної інтерполяції
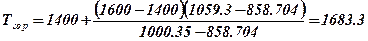 , К.
, К.
Отже, адіабатична температура горіння етиленгліколю при даних умовах рівна 1683.3 К.
8. Розрахунок концентраційних меж РОЗПОВСЮДЖЕННЯ
полум’я.
Однім з головних параметрів розвитку процесу горіння є можливість фронту полум’я розповсюджуватися на весь об'єм горючої суміші. Критичні умови, пов'язані з появою і поширенням полум’я, залежать від співвідношення між тепловиділенням за рахунок окислювальної реакції у системі та тепловіддачею у довкілля. Швидкість тепловиділення та кількість тепла, що виділилося залежать від концентрації компонентів, що реагують, температури та інших факторів. На цих висновках нижню концентраційну межу при якій можливо розповсюдження полум’я по горючій суміші.
 (24)
(24)
де Qгр - гранична теплота розповсюдження горіння, 1830 кДж/м3;
Q’’н - нижня теплота згорання, кДж/м3.
Граничні співвідношення цих компонентів називаються концентраційними межами розповсюдження полум’я (КМПП) і є одним з найважливіших показників вибухопожежонебезпеки речовин і матеріалів. Концентраційні межі характеризують можливість газу - та пароповітряних суміш до кінетичного горіння.
Розрізняють нижню та верхню концентраційну межу розповсюдження полум’я.
Нижньою (верхньою) межею розповсюдження полум’я називається мінімальний (максимальний) вміст горючої речовини у суміші з окислювачем, при якому можливе розповсюдження полум’я по суміші на будь-яку відстань від джерела запалювання.(jнjв).
Концентраційні межі можуть виражатись як в об’ємних відсотках (%) - об’ємна концентрація, так і в грамах на кубометр (г/мз) - масова концентрація.
Концентраційні межі застосовуються в практиці для оцінки вибухопожежонебезпеки виробництв, забезпечення безпеки технологічних процесів в періоди нормальної роботи, при пуску та зупинці, а також при проведенні вогневих робіт.
Виходячи з КМРП визначається область вибухонебезпечних концентрації, що лежить між нижньою та верхньою КМРП
jн < jф > jв
При проведенні ремонтних робіт, пов'язаних з застосуванням відкритого вогню та інструменту, при роботі котрого з’являються іскри, умови безпеки, а також для забезпечення вибухонебезпеки закритих апаратів з горючими газами фактична концентрація вибирається з урахуванням умов безпеки. При цьому область вибухонебезпечних концентрацій для пари та газів що знаходяться у закритих об’ємах визначається із умов що
jн.б < jф > jв.б,
де jн.б, jв.б, - нижня та верхня безпечна концентраційна межа розповсюдження полум’я, %.
Безпечні межі розповсюдження полум’я можуть бути визначені по формулам
jн.б £ 0,9(jн - 0,21)
jв.б ³ 1,1(jв + 0,42).
Для розрахунку нижньої концентраційної межі розповсюдження полум’я, можна скористатися більш точною методикою, що враховує вплив теплоти утворення речовини і вклад у теплоту згорання різних функціональних груп. Розрахунок проводиться по формулі
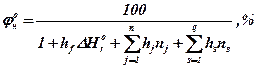 (25)
(25)
де DHоr - теплота утворення речовини у газоподібному стані, кДж / моль;
mj , mr - число атомів та структурних груп.
Значення коефіцієнтів hj, hs наведені в таблиці1.4
Таблиця №1.4
| hj | hs | hf | |||||
| hC | hH | hO | hN | hCl | hCºC | hO-C \C | 0.0246 |
| 9.134 | 2.612 | -0.522 | -0.494 | -3.57 | 7.88 | 6.50 |
Найбільш простою методикою розрахунку КМРП можна віднести розрахунок по апроксимаційній формулі
Об’ємну 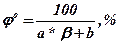 , (26)
, (26)
Масову 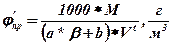 , (27)
, (27)
де a і b - коефіцієнти, приймаються по табл1.5; b - стехіометричний коефіцієнт у рівнянні реакції горіння; М - молярна маса речовини, кг/кмоль; Vt - мольний об'єм газу при заданих умовах, мз/кмоль.
Таблиця. 1.5 Коефіцієнти a, b - для визначення концентраційних меж розповсюдження полум’я
| Область застосування | Константи | ||
| a | b | ||
| Для НКМРП | 8.684 | 4.769 | |
| Для ВКМРП | При β £7.5 | 1.55 | 0.56 |
| При β > 7.5 | 0.768 | 6.554 |
Для більш точного визначення концентраційних меж розповсюдження полум’я можна використатися наступними формулами:
для нижньої концентраційної межи
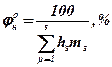 , (28)
, (28)
де hs - вміст s-тої структурної групи на концентраційні межі розповсюдження полум’я, що надані для НКМРП у таблиці № 1.6 для ВКМРП у таблиці №1.7
ms - число s-тої структурної групи у хімічної формулі речовини;
Таблиця № 1.6 Значення коефіцієнтів hs для НКМРП
| Вигляд структурної групи | Вигляд структурної групи | hs | |
| C-C | 3.75 | C-Cl | 0.71 |
| C=C | 11.10 | O-H | 0.52 |
| C-H | 4.47 | N-H | 1.90 |
| C-O | 0.90 | N-N | 13.84 |
| C=O | 3.12 | CºC | 31.05 |
| C-N (трьох валентний) | 2.27 | C=C (ароматичний зв’язок) | 7.36 |
Таблиця № 1.7 Значення коефіцієнтів hs для ВКМРП
| Вигляд структурної групи | hs | Вигляд структурної групи | hs |
| C-C | -0,84 | C-Cl | 0,71 |
| C=C | 0,24 | O-H | 1,25 |
| C-H | 1,39 | N-H | 0,69 |
| C-O | -1,40 | N-N | 13.84 |
| C=O | 1,31 | CºN | 2.07 |
| C-N (трьох валентний) | -1,17 | C=C (ароматичний зв’язок) | 0,89 |
| -C=O \ H | -1.47 | C= O< ï C= | 1.11 |
Для перерахунку об¢ємної концентрації у масову та назад можна використати формулу
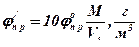 (29)
(29)
Вивчаючи теоретичний матеріал необхідно розглянути ці умови, визначити механізм їхнього впливу на межі розповсюдження полум’я та можливість їхнього використання на практиці для забезпечення безпеки технологічних процесів і припинення горіння на пожежі.
Приклад розв'язування задачі
Задача.
Розрахувати об’ємні і масові концентраційні межі розповсюдження полум’я та область вибухобезпечних концентрацій пари етилформіату C3H6O2 при стандартних умовах.
1. Складаємо рівняння реакції горіння етилформіату
C3H6O2 +3.5 (О2+3.76 N2)=3CO2+3H2O+3.5*3,76 N2
b = 3.5
2. Визначаємо молярну масу етилформіату
М=С*12+Н*1+О*16=3*12+6*1+2*16=74 кг/кмоль
3.По таблиці визначаємо коефіцієнти a та b для нижньої межі і вираховуємо нижню концентраційну межу
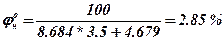
4. По таблиці визначаємо коефіцієнти a та b для верхньої границі і вираховуємо верхню концентраційну межу.
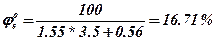
5. Визначаємо масову НКМРП в г/м3
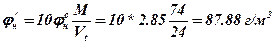
6. Визначаємо масову ВКМРП в г/мз
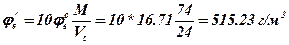
7. Визначаємо нижню безпечну межу розповсюдження полум’я
jн.б £ 0.9(2.85 - 0.21) £ 2.38 %
8. Визначаємо верхню безпечну межу розповсюдження полум’я
jв.б ³ 1.1(16.71 + 0.42) ³ 18.84 %
Висновок: таким чином встановлено, що концентраційні межі розповсюдження полум'я для етилформіату становлять 2.85 - 16.71 %, чи 87.88 - 515.23 г/м3. Суміш парів етилформіату з повітрям буде утворюватися при концентраціях менш 2.38 % чи більш 18.84 %.
Приклад розв'язування задачі
Задача.
Провести розрахунок концентраційних меж розповсюдження для етилформіату C3H6O2 з використанням формули (30).
1. Записуємо структурну формулу етилформіату
2. Виписуємо значення hs – вмісту s-тої структурної групи на КМРП. Для полегшення роботи складаємо таблицю
Табл.1.8
| Вигляд структурної групи | Кількість груп | hs | |
| Для НКМРП | Для ВКМРП | ||
| C-C | 3.75 | -0,84 | |
| C-H | 4.47 | 1,39 | |
| C-O | 0.90 | -1,40 | |
| C=O | 3.12 | 1,31 |
3. Визначаємо нижню та верхню концентраційну межу розповсюдження полум’я
Нижня концентраційна межа розповсюдження полум’я
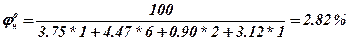
Верхня концентраційна межа розповсюдження полум’я
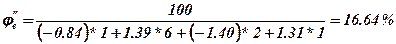
Висновок: область вибухонебезпечних концентрацій для етилформіату знаходиться від 2.82 до 16.64 %.
Приклад розв'язування задачі
Задача.
Визначити нижню концентраційну межу розповсюдження полум’я етиленгліколю (C2H6O2 ), якщо теплота його утворення рівна D Н of = -453.8 кДж / моль, а нижча молярна теплота згорання Qн= 1059.3, кДж / моль
1. Визначаємо нижню об’ємну теплоту згорання етиленгліколю при стандартних умовах
Дата публикования: 2015-09-18; Прочитано: 4793 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
