 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теплота утворення речовин 3 страница
|
|
Vpov=4.76*B*Vgg
Для горючих речовин у рідкому чи твердому агрегатному стані питомий об’єм теоретично необхідного повітря на кг речовини визначається перерахуванням. Знаючи, що більшість горючих речовин при горінні переходять у пароподібний чи газоподібний стан виразимо об’єм одержуваних пар використовуючи правило Авогадро як:
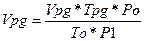
З врахуванням цього формула для визначення об’єму повітря при згорянні рідкої чи твердої горючої речовини що має хімічну формулу має вгляд.
При горінні одного кілограма горючого (питомий теоретичний об’єм).
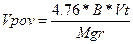
При горінні будь-якої кількості горючого (повний теоретичний об’єм).

В умовах реальної пожежі в зону реакції горіння повітря надходить більше, ніж необхідно для повного згоряння речовини. Відношення об’єму повітря, що потрапив у зону реакції горіння до теоретично необхідного об’єму повітря для повного згоряння речовини називається коефіцієнтом надлишку повітря.
У такий спосіб надлишок повітря, що надходить у зону реакції горіння цілком переходить у продукти горіння, і хоча він не брав участь у реакції об’єм повітря варто враховувати тому, що на його нагрівання затрачалася енергія реакції горіння. При горінні з великим коефіцієнтом надлишку повітря середнеобъемна температура продуктів горіння знижується.
Повний об’єм повітря при горінні речовини можна визначити так:
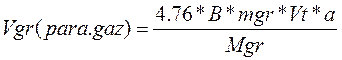
2.2. Питомий і повний об’єм продуктів згоряння при горінні речовин.
Перейдемо тепер до розрахунку об’єму продуктів горіння. На підставі рівняння хімічної реакції (незалежно від агрегатного стану горючого) маємо:
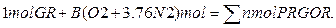
З врахуванням цього теоретичний об’єм продуктів горіння для речовин у газоподібному стані можемо одержати у виді формули:
при горінні одного кубометра горючого газу (питомий теоретичний об’єм)
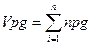
при горінні будь-якої кількості газу (повний тоеретичний об’єм)
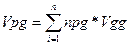
Для випадку, коли пальне знаходиться в рідкому чи твердому газоподібному стані, справедлива формула:
при горінні одного кілограма горючого (питомий теоретичний об’єм)
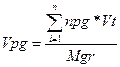
при горінні будь-якої кількості горючого (повний теоретичний об’єм)

Тому що, що надходить у зону реакції горіння зайве повітря в реакції не бере участь і переходить у продукти горіння, тому надлишковий об’єм повітря варто зараховувати в продуктах горіння в такий спосіб:

При горінні речовини відбувається значне підвищення температури і відбувається температурне розширення продуктів горіння. Зміна об’єму продуктів горіння можна визначити з універсального газового закону:
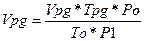
Процентний склад продуктів горіння можна легко визначити по формулі:
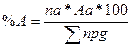
Матеріальний баланс процесу горіння при горінні суміші газів, твердих чи рідких речовин. Розрахунок необхідного об’єму повітря при горінні речовин складного складу.
Розрахунок матеріального балансу для суміші газів відбувається в принципі аналогічно случаю хімічно чистого газу, з тією лише різницею, що розрахунок виробляється для кожного компонента суміші окремо.
На підставі формул, отриманих для розрахунку кількості повітря, необхідного для згоряння 1 кмоля хімічно чистого газу, маємо:
Якщо в горючому газі присутній кисень, то він вступить у реакцію горіння і потрібний об’єм повітря буде менше:

Перейдемо тепер до розгляду процесу горіння твердих і рідких речовин. Склад їх у цьому випадку (у відмінності про газів) визначається в масових частках окремих чи елементів у %,причому для більшості горючих речовин таких елементів небагато – це C H O S. На підставі приведеного складу складної речовини можна теоретично об’єм повітря записати як:

Шляхом перерахування одержимо кінцеву формулу для визначення теоретичного об’єму повітря.
Напишемо відповідні реакції горіння окремих елементів
1. C + O2 --- CO2 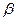 1 = 1
1 = 1
2. H2 + 0.5 O2 --- H2 O 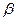 2 = 0.5
2 = 0.5
3. S + O2 --- SO2 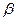 3 = 1
3 = 1
Визначимо питому массову витрату повітря на згоряння одного кілограма речовини.
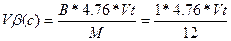
Тоді питома витрата повітря на згоряння одного кілограма складної речовини визначиться так:
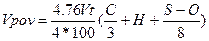
Де: З, Н, S, Об масовий зміст відповідного хімічного елемента в речовині %.
Теоретичний об’єм повітря для будь-якої кількості згорілого речовини при нормальних умовах визначається так:
Розрахунок об’єму продуктів горіння при горінні речовин складного складу.
Розрахунок об’єму продуктів горіння для газових сумішей може бути проведений шляхом послідовного визначення питомого об’єму кожного горючого компонента суміші з наступним врахуванням його об'ємного змісту. Так наприклад, для метану можна визначити об’єм продуктів горіння в такий спосіб:
1. Складаємо реакції горіння в повітрі
СН4+(О2+3.76N2)=CO2+H2O+3.76N2+Q
2. Визначається питомий об’єм кожного компонента в продуктах горіння
Питомий об’єм продуктів горіння одержуємо як суму питомих об’ємів
3. Для скорочення часу розрахунку, питомі об’єми компонентів одержуваних продуктів зведені в таблицю. Визначення об’єму продуктів згоряння з використанням таблиці зводиться до перемножування об'ємних часток компонентів на відповідні коефіцієнти з наступним їхнім додаванням по стовпчиках. Використовуючи цю методику ми можемо визначити питомий теоретичний обсяг продуктів згоряння для газових сумішей.
Розрахунок об’єму продуктів горіння складних речовин у рідкому чи твердому стані проводиться за методикою аналогічній методиці, тільки з використанням своєї таблиці. Наявність кисню в суміші приводить до зменшення кількості азоту в продуктах горіння.
Розглянемо це питання докладніше. Азот надходить у зону горіння разом з повітрям, і його тим більше, ніж необхідно для реакції кисню. Якщо ж частина необхідного для горіння кисню вже міститься в самій пальній речовині, то кисню повітря і, отже, самого повітря для реакції знадобиться менше. Це значить, що в зону реакції надійде і менше азоту.
Таб. 1. Визначення обєму продуктів складних горючих речовин.
| Назва горючої речовини | Объєм продуктів згорання м3 на м3 газу | |||
| СО2 | Н2О | N2 | SO2 | |
| Водень Оксид вуглецю Сірководень Метан Ацетилен Этилен Этан Пропан Бутан Пентан | 1,0 1,0 2,0 2,0 2,0 3,0 4,0 5,0 | 1,0 1,0 2,0 1,0 2,0 3,0 4,0 5,0 6,0 | 1,88 1,88 5,64 7,52 9,4 11,28 13,16 16,80 24,44 30,08 | 1,0 |
Таб. 2. Визначення об’єму продуктів горіння складних рідин та твердих речовин.
| назва компонентів | Объем продуктов горения м3 / кг | |||||
| CO2 | H2O | SO2 | N2 | P2O5 | ||
| Вуглець Водень Сірка Фосфор Азот в матеріалі Азот за рахунок кисню Волога в матеріалі | 1.86 | 11,2 1,24 | 0,7 | 7,0 21,0 2,63 4,7 0,8 -2,63 | 0,36 |
При гасінні пожеж необхідно пам'ятати про пожежонебезпечні і токсичні властивості продуктів горіння. Організовуючи гасіння пожеж варто вживати заходів для захисту особового складу від отруєння і можливих вибухів продуктів неповного горіння.
3. Методика розрахунку параметріВ процесу горіння.
Горіння на пожежі протікає у середовищі повітря. Тому при складанні рівнянь реакції горіння необхідно враховувати наступні особливості:
1. Рівняння складається виходячи з умови що кількість речовини – 1 моль горючої речовини. На відміну від рівнянь хімічних реакцій у рівнянні реакції горіння можуть бути присутні і дробові стехіометричні коефіцієнти. У рівнянні реакції горіння склад повітря записується як
(О2 + 3.76 N2)
Тоді, в загальному виді, рівняння реакції горіння має вигляд
Горюче +b(О2 + 3.76 N2)=Продукти горіння
2. При складанні рівняння реакції горіння вважається, що утворюються тільки продукти повного згорання. Виходячи з елементного складу визначається якісний склад продуктів горіння. В разі присутності у горючому:
Вуглецю С Утвориться - диоксид вуглецю СО2;
Водень Н - вода у вигляді пари Н2О;
Сірки S - сірки SO2;
Фосфору Р - фосфорний ангідрид Р2О5;
Кремінь Si - диоксид кремнію SiO2;
Метал - оксид металу;
Азоту N - азот у вигляді N2;
Галогени (F, Cl, Br, J) галогеноводні (HF, HCl, HBr, HJ).
Галогеноводні утворяться внаслідок взаємодії галогенів з атомами водню, що входять до складу горючої речовини.
Присутній у горючій речовині кисень О2 також вступає до реакції окислення подібно кисню повітря. Зразком може служити горіння вибухових та піротехнічних речовин:
С3Н5 (ОNО2)3 =3СО2 +2.5 Н2О+0,5 О2 +1.5N2
3. Для правильного укладання рівняння реакції горіння необхідно на початок порівняти кількість атомів вуглецю, після цього сірки, фосфору та кремнію, потім порівнюється кількість галогенів, після цього, кількість водню. Останнім порівнюється кількість атомів кисню та азоту у правій та лівій частині рівняння.
Кількість молей повітря, необхідного для повного згорання горючого показати стехіометричним коефіцієнтом, що можна визначити розрахунком за формулою.
 . (1)
. (1)
Розглянемо приклади складання рівнянь реакції горіння основних класів речовин у повітрі.
Вуглеводи: - горіння пропану у повітрі:
C3H8+5 (O2+3.76 N2)=3CO2+4H2O+5*3.76N2;
Кисневмісні: - горіння ацетону у повітрі:
C3H6O+4 (O2+3.76 N2)=3CO2+3H2O+4*3.76N2;
Азотовмісні: - горіння диетиламіну у повітрі:
C4H11N+6.75 (O2+3.76 N2)=4CO2+5.5 H2O+0.5 N2 +6.75 * 3.76N2;
ВИЗНАЧЕННЯ КОЛЬОРУ ДИФУЗІЙНОГО ПОЛУМ’Я.
При кінетичному горінні, при концентраціях близьких до стехіометричних, у зоні горіння утворяться кінцеві продукти реакції, диоксид вуглецю, азот та вода, що по здібності до випромінювання близькі до абсолютно білих тіл і тому світла практичні не випромінюють. По цій причині така зона горіння має слабко світній блакитний колір не залежно від його температури. Зона горіння, при кінетичному горінні, має жовтий чи жовтогарячий колір тільки в тому разі, коли горіння протікає при концентраціях близьких до верхньої концентраційної межі розповсюдження полум’я.
При дифузійному горінні колір полум’я залежить як від температури горіння, так і від хімічного складу горючої речовини.
При горінні речовин у зоні реакції відбувається процес термічного розпаду речовин на складні хімічні елементи, радикали та функціональні групи. Наприклад, при горінні ацетилену С2Н2 він по перше розкладається по наступної схемі
С2Н2 =2С+2Н,
і тільки після цього етапу розкладу відбуваються реакції окислення вуглецю
2С+4О=2СО2
та водню
2Н+ О =Н2О
до кінцевих продуктів.
Якщо у складі горючого багато вуглецю, те він може виділятися у вигляді сажі. Нагрів вуглецю у зоні горіння супроводжується його свіченням. Якщо в горючої речовині при термічному розпаді вуглець не утвориться або його утвориться мало (до моменту повного розпаду він устигає окислиться до СО), тоді така пальна речовина горить безколірним або блакитним полум’ям.
Наприклад, горіння метанової (мурашиної) кислоти СН2О2 можна представити як процес послідовних реакцій
СН2О2 = СО+ ОН+ Н;
СО +0.5 О2 = СО2 ;
ОН + 0.5 О2 =Н2О;
Н+0.5 О2 = Н2О.
З наведених реакцій видно, що мурашина кислота повинна горіти безколірним чи блакитним полум’ям.
При термічному розпаді ацетону окрім оксиду вуглецю та водню буде виділятися і молекулярний вуглець. Вуглець, знаходячись у полум’ї, розжарюється та світиться. Полум’я набуває червоного забарвлення.
С3Н6О =О +2С +6Н.
Але вуглець, що утворився при нормальному доступі повітря встигає окислиться до диоксиду вуглецю. Сажа при цьому не виділяється. Полум’я буде яскравим, але не кіптявим.
При горінні октану С8Н18 за рахунок його розпаду у зоні реакції утвориться настільки багато вуглецю, що шляхом дифузії кисню, що надходить не вистачає для окислення всього вуглецю до диоксиду вуглецю. Тому вуглець, що не прореагував у полум’я виділяється у вигляді сажі
С8Н18 = 8С + 18Н.
Полум’я при горінні октану буде яскраве та кіптяве.
Про характер світіння дифузійного полум’я при горінні приблизно можна судити по процентному вмісту кисню та вуглецю у горючїй речовині. Дані про характер світіння полум’я залежно від процентного вмісту компонентів зведені до таблиці № 1.
Таблиця 1. Залежність кольору полум’я від вмісту компонентів.
| Характер світіння полум’я | Вміст компонентів у горючої речовині в % | |
| Кисень | Вуглець | |
| Полум’я безколірне | Більше 50 | До 50 |
| Полум’я яскраве, не кіптяве | Від 25 до 50 | Від 50 до 60 |
| Полум’я яскраве, кіптяве | Менше 25 або відсутнє | Більш 60 |
Матеріальний баланс процесу горіння.
Розрахунок матеріального балансу процесу горіння зводиться до визначення об’єму повітря, необхідної для повної згорання горючої речовини, і продуктів горіння, що утворюються при цьому.
В реальних умовах горіння речовини може проходити з надлишком або з дефіцитом повітря.
Надлишок або недостача повітря визначається коефіцієнтом надлишку повітря.
aп , що показує, в скільки раз об’єм повітря, що надходить до зони горіння (Vпрo), більше об’єму повітря, теоретично необхідної для повного згорання (Vt) горючої речовини.
 . (2)
. (2)
Методика розрахунку процесу горіння залежить від складу та агрегатного стану речовини згідно з рівнянням реакції горіння.
Число молів повітря та продуктів горіння, що приходяться на один моль горючої речовини при згорянні визначається з рівняння реакції горіння наступним чином:
1. Складається рівняння реакції горіння
Горюче +b(О2+3.76 N2)=Продукти горіння
2. Визначається теоретичне число молів повітря, та теоретичне число молів продуктів горіння, що приходяться на один моль горючої речовини
uоп = (1+3.76)b = 4.76b, моль/моль; (3)
де b - стехіометричний коефіцієнт в рівнянні реакції.
uопг = Snпгі, моль/моль (4)
де Sппг - сума молей продуктів горіння.
3. При горінні з надлишком повітря (aпр > 1) при розрахунку матеріального балансу враховується об’єм повітря, що приймав участі в горінні.
Дійсне число молів повітря, що приходяться на один моль горючої речовини визначається як
uп = uоп*aп, моль/моль. (5)
Дійсне число молів продуктів горіння, що приходяться на один моль горючої речовини визначається як
uпг = uопг + (aп - 1) uоп, моль/моль. (6)
4. Якщо необхідно визначити процентний склад продуктів горіння, те повна сума молей продуктів горіння приймається за 100%, а вміст якогось (i-го) продукту горіння визначається з співвідношення.
 ; (7)
; (7)
В тому разі, коли горіння протікає з надлишком повітря в продуктах горіння буде присутній кисень, а при розрахунку вмісту азоту необхідно врахувати і азот, який перейшов з надлишком повітря
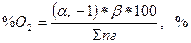 ; (8)
; (8)
 . (9)
. (9)
При визначенні матеріального балансу речовини у рідинному стані потрібно провести розрахунки для одиниці маси речовини, тобто для одного кілограму речовини. При гомогенному горінні речовин у рідинному агрегатному стані проходить їхній перехід до газоподібної фази, об’єм горючих газів або пари, що при цьому утворяться можна визначити за формулою.
 , м3/кг
, м3/кг
де V t - молярний об’єм газу при заданих умовах, м3/кмоль;
Мс - молярна маса речовини, кг/кмоль.
Таким чином, питомий об’єм повітря, необхідний для згорання одного кілограму горючої речовини та питомий об’єм продуктів горіння визначається як
 , м3/кг; (10)
, м3/кг; (10)
 , м3/кг. (11)
, м3/кг. (11)
При визначенні об’єму повітря та продуктів горіння з урахуванням надлишку повітря можна використовувати формули 5 та 6 у наступному вигляді:
vп = vоп*aп
vпг = vопг + (aп - 1) vоп,
Для визначення теоретичного об’єму повітря, необхідного для згорання будь-якої кількості горючого у рідинному стані, або об’єму продуктів згорання необхідно питомий об’єм помножити на масу речовини, що згоріла
V п = vп mгр, м3; (12)
V пг = vпг mгр, м3; (13)
де mгр - маса речовини, що згоріла, кг;
Якщо вимагається визначити об’єм продуктів горіння при температурі пожежі, те необхідно враховувати також теплове розширення, і тоді кінцевий їхній об’єм визначається по формулі
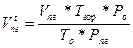 м3 (14)
м3 (14)
Подальші розрахунки по визначенню об’єму повітря, продуктів згорання та їхнього складу виконуються по раніше розглянутій методиці.
Розв'язування задачі по розрахунку матеріального балансу при горінні речовини індивідуального хімічного складу у рідинному стані виконується у наступній послідовності:
1. Складається рівняння реакції горіння;
2. Визначається теоретичне число молів повітря uоп, та теоретичне число молів продуктів горіння uопг;
3. Визначається дійсне число молів повітря uп, та дійсне число молів продуктів горіння uпг з урахуванням надлишку повітря;
4. Визначається склад продуктів горіння;
5. Розраховується молярна маса горючої речовини М та молярний об’єм ідеального газу при заданих умовах V t
6. Визначається теоретичний об’єм повітря vоп, та теоретичний об’єм продуктів горіння vопг;
7. Визначається дійсний об’єм повітря vп, і продуктів горіння vпг при заданих умовах.
Приклад розв'язування задачі
Задача 2.
Провести розрахунок матеріального балансу процесу горіння етиленгліколю (C2H6O2 ), якщо горіння проходило при температурі навколишньої середовища 10oC, тиску повітря 100.0 кПа, коефіцієнт надлишку повітря a п =1,8.
Рішення:
1. Складаємо рівняння реакції горіння.
C2H6O2+ 2.5 (O2+3.76 N2)=2CO2+3H2O+2.5 * 3,76 N2
b=2, 5
2. Визначаємо теоретичне число молів повітря uоп, та теоретичне число молів продуктів горіння uопг.
uоп = 4.76b = 4.76* 2.5 = 11.9 моль/моль;
uопг = uопг = Snпгі = 2 + 3+ 2.5* 3.76 = 14.4 моль/моль.
3. Визначаємо дійсне число молів повітря uп, та дійсне число молів продуктів горіння uпг з урахуванням надлишку повітря.
uп = uоп*aп = 11.9 * 1.8 = 21.4, моль/моль
uпг = uопг + (aп - 1) uоп = 14.4 + (1.8-1)* 11.9 =23.9, моль/моль.
4. Визначаємо склад продуктів горіння;
4.1. визначаємо вміст CO2 в продуктах горіння.
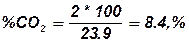 .
.
4.2. визначаємо вміст Н2О в продуктах горіння.
 .
.
4.3. визначаємо вміст О2 в продуктах горіння.
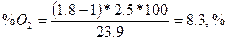
4.4. визначаємо вміст N2 в продуктах горіння.
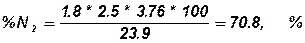
5. Розраховуємо молярну масу горючої речовини М та молярний об’єм ідеального газу при заданих умовах V t
Визначаємо молярну масу етиленгліколю:
M =2 *12+6 *1 + 2* 16 =62 кг/кмоль.
Визначаємо об’єм 1кіломоля газу при заданих умовах.
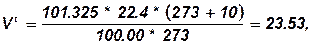 м3/кмоль.
м3/кмоль.
6. Визначається теоретичний об’єм повітря vоп, та теоретичний об’єм продуктів горіння vопг;
Теоретичний об’єм повітря vоп
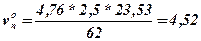 , м3/кг,
, м3/кг,
Теоретичний об’єм продуктів горіння vопг.
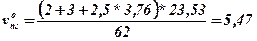 , м3/кг,
, м3/кг,
7. Визначаємо дійсний об’єм повітря vп, і продуктів горіння vпг при заданих умовах
Дійсний об’єм повітря vп.
vп = 4,52 *1.8=8,14, м3/кг.
Дійсний об’єм продуктів горіння vпг.
vпг = 5,47+(1.8-1) * 4,52 = 9,09, м3/кг.
Висновок: Для повного згорання одного кілограму нафталіну необхідно vоп = 4.52 м3/кг повітря, об’єм продуктів горіння складе, vопг = 5.47 м3/кг. При згорянні при заданих умовах буде використано vп = 8,14 м3/кг повітря, при цьому буде утворено vпг =9.09 м3/кг продуктів горіння. Слад продуктів горіння буде наступним: CO2 - 8.4 %, Н2О - 12.5 %, О2 - 8.3 %N2 - 70.8 %.
4. Енергетичний баланс процесів горіння
Хімічні реакції можуть проходити з поглинанням або виділенням енергії. Реакції, що протікають з поглиненням енергії, називаються ендотермічними.
Реакції горіння є екзотермічними, а тепло, що виділяється в результаті реакції горіння, можна назвати тепловим ефектом.
Дата публикования: 2015-09-18; Прочитано: 853 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
