 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Визначення максимального тиску при вибуху
|
|
Кінетичне горіння готової газо- повітряної або паро- повітряної суміші протікає з такою швидкістю, що горюча суміші встигає згоріти ще до теплового розширення продуктів реакції. Процес горіння при вибуху протікає при постійному об’ємі. Продукти горіння нагріваються у дві стадії: внаслідок хімічної реакції і адіабатичного стиску.
Максимальний тиск при вибуху визначається з універсального газового закону
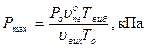 (30)
(30)
де Рвиб -максимальний тиск при вибуху, кПа;
Ро - початковий тиск горючої суміші, кПа;
Твиб - максимальна температура при адіабатичному згоранні суміші при постійному об’ємі, К;
То - початкова температура, К;
uопг - кількість молів продуктів реакції горіння, моль/моль;
uісх - кількість молів продуктів реакції горіння, моль/моль;
При розрахунку максимальної температури вибуху приймаються наступні умови:
- горіння протікає при стехіометричній концентрації a п = 1;
- початкова температура суміші рівна 298.15 К;
- відбувається адіабатичне горіння суміші при постійному об’ємі;
- відбувається повне згорання речовини без температурної дисоціації продуктів горіння.
Температура продуктів горіння при вибуху визначається по методиці, по якій визначається і температура горіння з тією різницею, що визначається не тепловміст продуктів горіння при постійному тиску, а їх внутрішня енергія при постійному об’ємі.
Методика визначення максимального тиску вибуху наступна:
1. Складається рівняння реакції горіння
2. Визначається теоретичне число молів продуктів горіння uопг;
3. Визначається теоретичне число молів початкової суміші uoвих;
4. Визначається нижча теплота згорання речовини з закону Гесса або по довідковим даним;
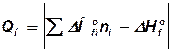 , кДж/моль, (31)
, кДж/моль, (31)
5. Визначається внутрішня енергія початкової суміші
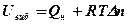 . кДж/моль,
. кДж/моль,
де R – універсальна газова стала, R= 8,314*10-3 кДж/(моль*К);
Т- температура початкової суміші, К;
Dп - різниця між числом молів продуктів горіння та початкової суміші, кмоль/кмоль.
6. Визначається середній тепловміст продуктів вибуху Uср
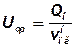 , кДж/моль; (32)
, кДж/моль; (32)
7. Орієнтуючись на внутрішню енергію азоту, визначається температура вибуху Т1 у першому наближенні з використанням даних внутрішньої енергії продуктів горіння при постійному об’ємі, таблиця № 4 додатку;
8. Визначається внутрішня енергія продуктів вибуху Uпг1 при температурі вибуху Т1
Uпг1=SUi u пгi кДж/моль; (33)
9. Визначається температура вибуху у другому наближенні виходячи з того, що друге значення Т2 повинно бути менше, якщо теплота вибуху більше внутрішньої енергії продуктів вибуху або більше, якщо внутрішня енергія продуктів вибуху менш внутрішньої енергії;
10. Визначається внутрішня енергія продуктів вибуху Uпг2 при температурі вибуху Т2
Uпг2=SUi u пгi, кДж/моль; (34)
11. Визначається температура вибуху методом лінійної інтерполяції
 , К; (35)
, К; (35)
12. Визначається максимальний тиск при вибуху
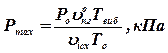 (36)
(36)
Приклад розв'язування задач
Задача
Визначити максимальний тиск при вибуху пари етилацетату C4H8O2, якщо початкова температура середовища tj = 25 оС, а тиск Ро = 100 кПа. Теплота утворення етилацетату DНоf =-442.9 кДж/моль.
1. Складаємо рівняння реакції горіння
C4H8O2+ 5(О2 + 3,76N2) = 4CO2 + 4H2O + 5*3.76 N2
2. Визначаємо теоретичне число молів продуктів горіння uопг;
uопг= 4 + 4 + 5*3.76 = 26.8,, моль/ моль
3. Визначаємо теоретичне число молів початкової суміші uoісх;
uісх = 1 + 5*4,76 = 24,8, моль/ моль
4. Визначаємо нижчу теплоту згорання етилацетату.
Qн = ½4*(-393,78)+4*(-241,84)-442,9½ =2099,58 кДж/моль,
5. Визначаємо внутрішню енергію початкової суміші.
Dп= 26,8 – 24,8 = 2, моль/ моль
Uвиб = 2099,58 + 2*8,314*10-3 * 293 =2104,45, кДж/моль,
6. Визначаємо середній тепловміст продуктів вибуху Uср
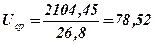 , кДж/моль;
, кДж/моль;
7. Орієнтуючись на внутрішню енергію азоту, визначаємо температуру вибуху у першому наближенні Т1= 3000 К
8. Визначаємо внутрішню енергію продуктів вибуху Uпг1 при температурі вибуху Т1
Uпг1= 137,72* 4+ 113,18 * 4 + 76,92* 5*3,76 = 2449,7, кДж/моль;
9. Визначаємо температуру вибуху у другому наближенні виходячи з того, що друге значення Т2= 2600 К.
10. Визначаємо внутрішню енергію продуктів вибуху Uпг2 при температурі вибуху Т2
Uпг2= 116,19* 4+ 93,95 * 4 + 65,44* 5*3,76 = 2070,8 кДж/моль;
11. Визначаємо температуру вибуху методом лінійної інтерполяції
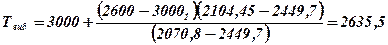 К;
К;
12. Визначається максимальний тиск при вибуху

9. ТЕМПЕРАТУРНІ МЕЖІ РОЗПОВСЮДЖЕННЯ ПОЛУМ’Я.
Температури рідини, при яких над її поверхнею утворюються концентрації насиченої пари, які дорівнюють нижній або верхній концентраційним межам розповсюдження полум’я, називають відповідно нижньою tн (НТМРП) або верхньою tв (ВТМРП) температурними межами розповсюдження полум’я.
Температурні межі розповсюдження полум’я можуть бути використані для визначення пожежовибухонебезпеки технологічного обладнання у якому зберігаються чи переробляються горючі рідини.
У тому разі, якщо температура апарата з горючою рідиною влучає між нижчою та верхньою температурною межею розповсюдження полум’я фактична концентрація пари буде знаходиться у зоні вибухонебезпечних концентрацій. Тому вважається, що вибухонебезпечна концентрація насиченої пари утворюється коли виконуються умова
tн £ tроб ³ tв
Для забезпечення пожежної безпеки технологічних процесів, пов’язаних з використанням горючих рідин, останній проводять при температурах дещо нижчих за НТМРП і вищих за ВТМРП. Ці температури називають безпечними температурними межами розповсюдження полум’я. Їх враховують також при зберіганні та транспортуванні горючих рідин. Розрахунок безпечних ТМРП можна проводити по рівнянню з константами Антуана, підставляючи в нього безпечні КМРП. Для приблизних розрахунків досить гарний результат можуть даті розрахунки безпечних ТМРП по формулам
t н без £ 0.9 (tн - Кб);
t в без ³ 1.1 (tв + Кб),
де Кб - коефіцієнт безпеки, який для індивідуальних речовин та нафтопродуктів дорівнює 10.5 оС, а для технічних сумішей 14 оС.
Безпечними вважають температури нижчі за нижню та вищі за верхню безпечні межі розповсюдження полум’я.
Для розрахункового визначення ТМРП можна використовувати формулу, що враховує залежність тиску насиченої пари від констант Антуана.
 , оС (мм)
, оС (мм)
де А, В, Са - константи рівняння Антуана;
Рзаг - атмосферний тиск, кПа;
jн(в) - концентраційні межі розповсюдження полум’я, %.
Методика визначення температурних меж розповсюдження полум’я з використанням констант Антуана
1. Визначити концентраційні межі розповсюдження полум’я розрахунком чи з використанням довідників;
2. Знайти константи Антуана з довідників чи таблиці № 10 додатку;
3. Визначити температурні межі розповсюдження полум’я.
Приклад розв’язування задачі
Задача.
Визначити температурні межі розповсюдження полум’я етилацетату C4H8O2 при стандартних умовах (t = 20 оС, Рзаг = 101.3 кПа), використовуючи константи Антуана.
1. Визначаються концентраційні межі розповсюдження полум’я для етилацетату розрахунком
1.1. Складається рівняння реакції горіння
C4H8O2+ 5(О2 + 3,76N2) = 4CO2 + 4H2O + 5*3.76 N2
1.2. Визначаються нижня та вища об’ємна концентраційні межі розповсюдження полум’я
нижня КМРП 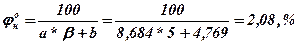 ,
,
вища КМРП 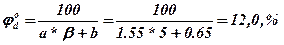 ,
,
2. Знаходяться константи Антуана по таблиці 10 додатку:
А = 6.2267 В = 1244.95 Са = 217.88
3. Визначаються температурні межі розповсюдження полум’я этилацетату
3.1. Нижня температурна межа розповсюдження полум’я
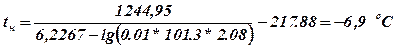
3.2. Верхня температурна межа розповсюдження полум’я
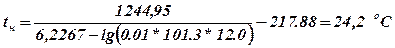
Висновок: При температурах від –6,9 до 24,2 оС насичена пара етилацетату утворює вибухонебезпечну концентрацію.
Температурні межі розповсюдження полум’я можна визначити враховуючи залежність їх зміни температури кипіння у гомологічних рядках по емпіричній формулі
tн(в) = k * tкип - l, оС (мм)
де k, l - коефіцієнти для деяких гомологічних рядів, таблиця №5;
tкип - температура кипіння рідини.
Методика визначення температурних меж розповсюдження полум’я з використанням емпіричної формули.
1. Визначається температура кипіння рідини з довідників чи з таблиці додатків. Треба враховувати, що температура, при якій насичена пара рідини утворює тиск 101,3 кПа може бути прийнята за температуру кипіння.
2. Визначається хімічний клас рідини та згідно з таблицею №13 додатків коефіцієнти k, l.
3. Визначаються температурні межі розповсюдження полум’я.
Приклад розв’язування задачі
Задача
Визначити температурні межі розповсюдження полум’я етилформіату C3H6O2 при стандартних умовах.
1. Визначаємо температуру кипіння етилформіату tкип = 54.3 оС
2. Етилаформіат відноситься до складних ефірів мурашиної кислоти
kн =0.5359, l н = 47.6
kв =0.6050, lв = 25.0
3. Визначаємо температурні межі розповсюдження полум’я.
tн = 0.5359 * 54.3 - 47.6 = -18,5 оС (мм)
tв = 0.6050 * 54.3 - 25.0 = 7,8 оС (мм)
Висновок: Таким чином можна зробити висновок, що температурні межі розповсюдження полум’я етилформіату дорівнюють tн = -18,5 оС, tв =7,8 оС.
Враховуючі температуру кипіння та хімічну структуру рідини температурні межі розповсюдження полум’я можна визначити по формулі
tн(в) = a0 + a1 * tкип + aj * lj,оС (мм)
де - а0, а1 - коефіцієнти, які дорівнюють:
для НТМРП а0 = -62.40оС; а1 = 0.655
для ВТМРП а0 = -41.43 оС; а1 = 0.723
- кількість структурних груп lj;
aj, - емпіричний коефіцієнт, що характеризує кількість -х структурних груп, поданий у таблиці №. 6.
Методика визначення температурних меж розповсюдження полум’я з урахуванням хімічної структури речовини
1. Визначається температура кипіння рідини.
2. Записується структурна формула речовини
3. Визначається кількість структурних груп lj , та показник структурної групи aj
4. Визначаються температурні межі розповсюдження полум’я.
Приклад розв’язування задачі
Задача
Визначити температурні межі розповсюдження полум’я етиленгліколю C2H6O2 при стандартних умовах.
1. Визначаємо температура кипіння рідини tкип = 197.8 оС;
2. Записуємо структурну формулу етиленгліколю.
3. Визначаємо кількість структурних груп lj , та показник структурної групи aj
l1 С – С = 1 ajн = -0.009 ajв = 0.570
l2 С –Н = 4 ajн = -0.909 ajв = -1.158
l3 С –О = 2 ajн = 0.110 ajв = 1.267
l4 О – Н = 2 ajн = 19.80 ajв = 17.80
4. Визначаються температурні межі розповсюдження полум’я.
tн = -62.46+0.655*197.8+(-0.009)*4+(-0.909)*1+0.110*2+19.75*2=105.9 оС.
tв = -41.43+0.723*197.8+0.570*4+(-1.158)*1+1.267*2+17.80*2=140.8 оС.
Висновок: Температурні межі розповсюдження полум’я етиленгліколю дорівнюють tн = 105,9 оС, tв =140.8 оС.
Температурні межі розповсюдження полум’я можна визначити по методу лінійної інтерполяції. Розрахунок проводиться з використанням табличних значень тиску насиченої пари (Додаток, таблиця), для цього необхідно:
1. Визначити КМРП з довідкової літератури, або за будь-якою розрахунковою методикою;
2. Визначити тиск насиченої пари на нижній та верхній МРП по формулі:
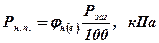 (мм)
(мм)
3. По таблиці додатку для даної речовини визначити найближчі до розрахованих, значення тиску насиченої пари Р1 (ліворуч) та Р2 (праворуч), а також відповідні їм температури t1 и t2.
4. Знайти значення ТМРП методом лінійної інтерполяції по формулі:
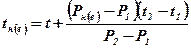 ,оС (мм)
,оС (мм)
Приклад розв’язування задачі.
Задача.
Визначити температурні межі розповсюдження полум’я етилацетату C4H8O2 методом лінійної інтерполяції, якщо загальний тиск складає Рзаг = 101,3 кПа.
1. Визначаємо концентраційні межі розповсюдження полум’я для етилацетату розрахунком.
1.1. Складаємо рівняння реакції горіння.
C4H8O2+ 5(О2 + 3,76N2) = 4CO2 + 4H2O + 5*3.76 N2
1.2. Визначаємо нижню та вищу об’ємну концентраційну межу розповсюдження полум’я
нижня КМРП 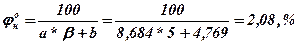 ,
,
вища КМРП 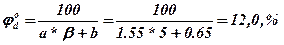 ,
,
2. Визначаємо тиск насиченої пари при нижній та верхній концентраційної МРП:
для нижньої КМРП 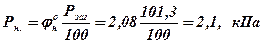
для вищої КМРП 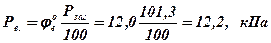
3. Визначаємо найближчі до розрахованих значення тиску насиченої пари Р1 (ліворуч) та Р2 (праворуч), а також відповідні їм температури t1 и t2. для нижчого КМРП.(табл. 10)
Дата публикования: 2015-09-18; Прочитано: 970 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
