 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
З а д а ч і 3 страница
|
|
Рисунок 16 – Діаграма стану титан-вольфрам
89.Скориставшись діаграмою стану системи олово-цинк (рис. 17):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за цинком розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?
|



|

|

|


|

Рисунок 17 – Діаграма стану олово-цинк
90. Скориставшись діаграмою стану системи залізо-мідь (рис. 18):
1) визначити масу і склад фаз, на які розпадається 10 кг 20%-ного за залізом розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?
|

|




|
|
|


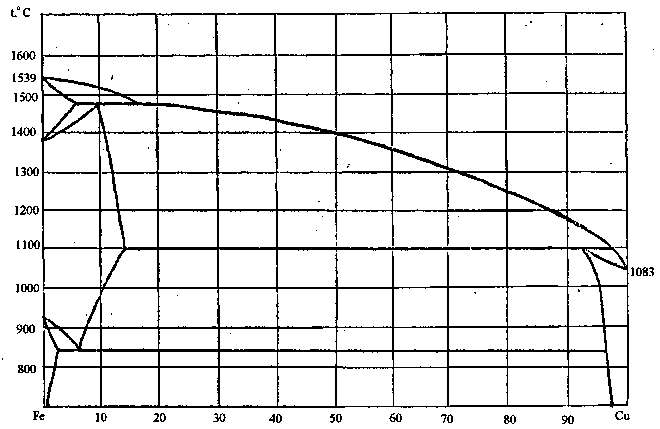
Рисунок 18 – Діаграма стану залізо-мідь
91. Скориставшись діаграмою стану системи свинець-магній (рис. 19):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за магнієм розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?




|
|
|
|



|
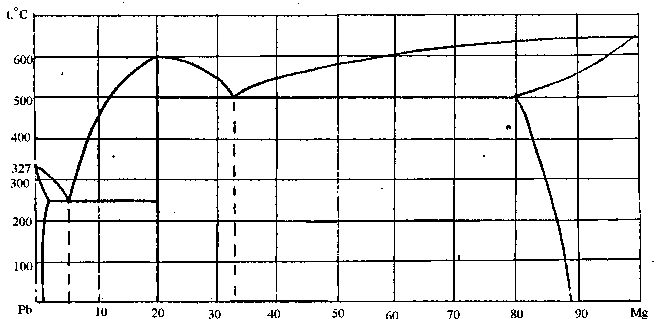
Рисунок 19 – Діаграма стану свинець-магній
92. Скориставшись діаграмою стану системи срібло-германій (рис. 20):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за германієм розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?

|
|



|


|

|
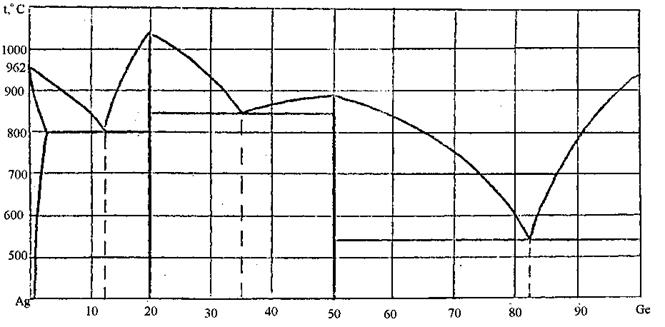
Рисунок 20 – Діаграма стану срібло-германій
93. Скориставшись діаграмою стану системи олово-цинк (рис. 21):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за цинком розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?
|
|
|






|
|

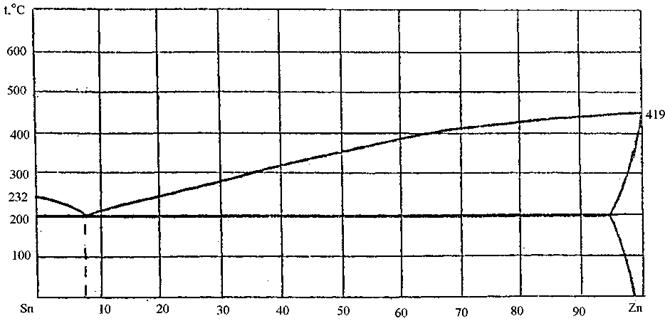
Рисунок 21 – Діаграма стану олово-цинк
94. Скориставшись діаграмою стану системи мідь-нікель (рис. 22):
1) визначити масу і склад фаз, на які розпадається 50 кг 70%-ного за міддю розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?



|
|

|



|
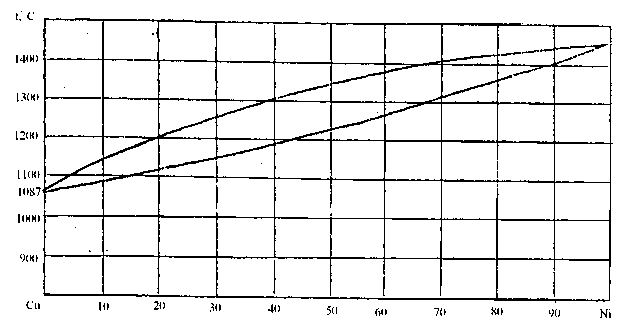
Рисунок 22 – Діаграма стану мідь-нікель
95. Скориставшись діаграмою стану системи сульфід заліза-сульфід марганцю (рис. 23):
1) визначити масу і склад фаз, на які розпадається 10 кг 80%-ного за сульфідом маганцю розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих областях?
3) Скільки ступенів свободи має система в точках 1-6?
|




|
|



|
|
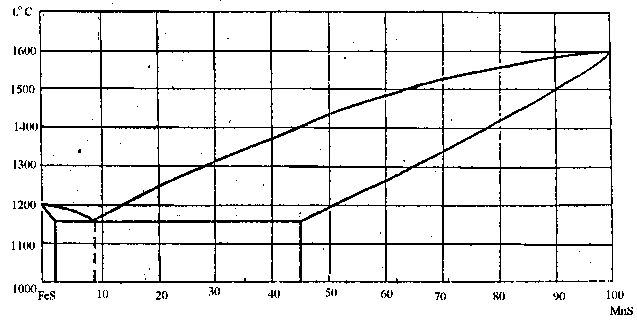
Рисунок 23 – Діаграма стану сульфід заліза-сульфід марганцю
96. Скориставшись діаграмою стану системи срібло-скандій (рис. 24):
1) визначити масу і склад фаз, на які розпадається 10 кг 90%-ного за скандієм розплаву, охолодженого до точки В;
2) яким станам системи (гомогенні чи гетерогенні) відповідають області, позначені римськими літерами. Які фази співіснують в цих облас
3) Скільки ступенів свободи має система в точках 1-6?
|


|

|
|
|




|
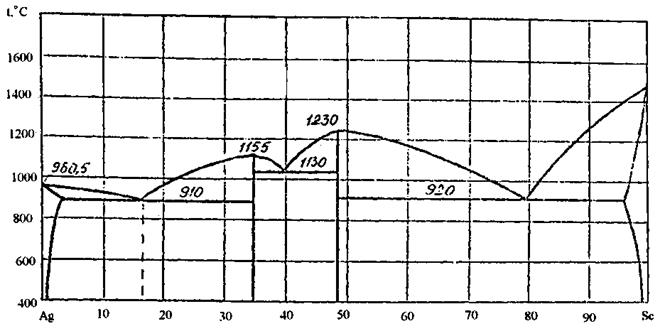
Рисунок 24 – Діаграма стану срібло-скандій
97. Визначте температуру кипіння, температуру кристалізації і тиск насиченої пари при 250С розчину, який вміщує 0,05 моль нелеткої біологічно активної речовини (неелектроліту) у 200 г води. Тиск насиченої пари води при 250С дорівнює 3,167 кПа. Відповідь: 3,153 кПа.
98. Визначити масову частку водного розчину етиленгліколю, температура замерзання якого -0,50С, маса води складає 200 г. Відповідь: 0,016.
99. При 300С осмотичний тиск розчину, 100 мл якого вміщує 0,1778 г сечовини, дорівнює 74660 Па. Визначте молярну масу сечовини (концентрацію розрахувати в моль/м3).
Відповідь: 60 г/моль.
100. Розчин, який містить 0,785 г саліцилової кислоти у 20 г етанолу, кипить при температурі на 0,3370С вищій, ніж чистий спирт, ебуліоскопічна константа якого дорівнює 1,190. Визначте молярну масу саліцилової кислоти. Відповідь: 138,6 г/моль.
101. Температура кипіння чистого CS2 319,2 К. Розчин, який містить 0,217 г сірки в 19,18 г CS2 (ебуліоскопічна константа дорівнює 2,370) кипить при 319,304 К. Визначте кількість атомів у молекулі сірки. Відповідь: 8.
102. Розчин, якій містить 0,12 г жовтого фосфору в 20 г сірковуглецю (ебуліоскопічна константа дорівнює 2,370), закипає при температурі на 0,120 вищій, ніж чистий розчинник. Розрахуйте, скільки атомів входить до складу молекули фосфору. Відповідь: 4.
103. Водний розчин містить 0,5% сечовини і 1% глюкози. Яка температура його кристалізації? Яка з розчинених речовин більше впливає на зниження температури кристалізації розчину? Відповідь: -0,262; сечовина.
104. Температура кипіння розбавленого водного глюкози вища за температуру кипіння води (ебуліоскопічна константа дорівнює 0,520). Розрахуйте відносне зниження тиску насиченої пари води у цьому розчині (у %). Відповідь: 1,03%.
105. Розчин, який містить 0,345 г ацетаніліду С6Н5ОNС2Н3 у 25 г фенолу, кристалізується при 40,240С. Визначте кріоскопічну сталу фенолу, якщо температура його кристалізації дорівнює 410С. Відповідь: 7,43.
106. Відносне зниження тиску насиченої пари водного розчину, який містить 0,1 моль сахарози, становить 0,00189. Визначте осмотичний тиск розчину при 293 К. Густина розчину 1г/мл. (Концентрацію розрахувати в моль/м3). Відповідь: 2,5•105 Па.
107. Визначте зниження температури замерзання крові, якщо її осмотичний тиск дорівнює 7,7•105 Па при 310 К. При розв'язанні задачі прийміть, що молярність розчину дорівнює моляльності. Кріоскопічна константа розчинника дорівнює 1,860. Відповідь: 0,560.
108. Обчисліть температуру кипіння водного розчину (ебуліоскопічна константа дорівнює 0,520) з масовою часткою новокаїну (М=272,8 г/моль) 2%, який використовують як місцевоанестезуючий засіб. Відповідь: 100,0380С.
109. Розрахуйте молярну масу органічної сполуки, якщо тиск насиченої пари розчину, який має в своєму складі 4,7 г сполуки в 100 г CCl4, дорівнює при 200С 11199 Па, а тиск насиченої пари CCl4 становить 12132 Па. Відповідь: 86,8 г/моль.
110. Відносне зниження тиску пари водного розчину, який містить нелетку речовину становить 0,02. Визначте моляльність розчину. Відповідь: 1,134 моль/кг.
111. При Т=298 К тиск пари води дорівнює 3159,68 Н/м2. Визначити, який тиск пари буде над водою, в якій масова частка гліцерину становить 10%. Відповідь: 3079,69 Н/м2.
112. Питома теплота випаровування води при температурі кипіння дорівнює 2,464 Дж/г. Визначте температуру кипіння водного розчину, що містить 0,05 моль нелеткої розчиненої речовини в 200 г води. Відповідь: 373,128 К.
113. Водний розчин, що містить нелетку розчинену речовину замерзає при 271,5 К. Визначте температуру кипіння розчину і тиск його пари при 298 К. Кріоскопічна постійна для води 1,86, ебуліоскопічна константа - 0,523, тиск пари чистої при 298 К дорівнює 3167,21 Н/м2. Відповідь: 3121,6 Н/м2.
114. Розчинність кисню у воді при тиску 399,9•102 Н/м2 і температурі 298 К дорівнює 16•10-3 кг/м3. Визначити коефіцієнт Генрі. Відповідь: 4•10-7 кг/Н•м.
115. Тиск насиченої пари розчинника над розчином 2,76 г деякої речовини в 100 г хлороформу при 298 К дорівнює 185,4 мм.рт.ст. Розрахувати молярну масу речовини, якщо при цій температурі тиск насиченої пари над індивідуальним хлороформом становить 196,8 мм.рт.ст. Відповідь: 53,5 г/моль.
116. Розрахувати ебуліоскопічну константу для бензолу, якщо його температура кипіння 353,25 К, а молярна теплота випаровування дорівнює 30,90 кДж/моль. Відповідь: 2,62.
117. При 220С і тиску 390 мм.рт.ст. розчинність H2S в аніліні дорівнює 10,6 г/л, а при 1160 мм.рт.ст. і тій же температурі 31,6 г/л. Чи виконується закон Генрі? Відповідь: так.
118. Змішали 0,5 моль речовини А з 0,3 моль речовини В при 270С. Розрахувати зміну ентропії та зміну енергії Гіббса, якщо відомо, що речовини А і В утворюють доскональний розчин. Відповідь: 5,5Дж; -1651,2Дж.
119. Змішали 0,1 моль речовини А з 0,2 моль речовини В при 250С. Розрахувати зміну ентропії та зміну енергії Гіббса, якщо відомо, що речовини А і В утворюють доскональний розчин. Відповідь: 1,59Дж; -473,5Дж.
120. CCl4 та SnCl4 утворюють ідеальний розчин. Визначити склад розчину (мольні частки), який кипить при 1000С під тиском 1 атм. Парціальні тиски парів CCl4 та SnCl4 при 1000С відповідно дорівнюють 1450 і 500 мм.рт.ст. Відповідь: 0,274; 0,726.
121. Розчин, який складається з бензолу та толуолу, містить 30% толуолу. Визначити загальгий тиск пари розчину і склад пари (у мольних частках). Тиск пари бензолу дорівнює 120,2 мм. рт. ст., а толуолу 36,7 мм. рт. ст. Відповідь: 97,91 мм.рт.ст.; 0,9; 0,1.
122. Тиск парів речовин А і В відповідно дорівнюють 350 і 760 мм. рт. ст. Визначити склад пари над розчином, отриманого змішуванням 0,5 моль А з 0,7 моль В. Відповідь: 0,248; 0,752.
123. При 50 ºС тиск пари бензолу дорівнює 269 мм. рт. ст., а тиск пари бромбензолу 17 мм. рт. ст. Чому дорівнюють мольні частки бензолу та бромбензолу в розчині, якщо мольна частка бензолу в парі становить 0,5. Відповідь: 0,94; 0,06.
124. Скільки грам гліцерину (С3Н8О3) потрібно розчинити у 200 г води, щоб відносне зниження тиску пари розчину склало на 10%? Відповідь: 113,5 г.
125. Скільки олова (в г.) потрібно розчинити в 50 г ртуті,щоб тиск пари ртуті понизився від 709,9 до 700 мм. рт. ст. Відповідь: 0,421 г.
126. Водний розчин кипить при 101 ºС. Чому дорівнює тиск розчинника над розчином, якщо тиск пари води дорівнює 787,5 мм. рт. ст., а мольна частка розчиненої речовини 0,043? Відповідь: 753,6 мм.рт.ст.
127. Розчинність кисню у воді при тиску 39997 Па і температурі 250С дорівнює 16 мг/л. Визначити коефіцієнт Генрі (концентрацію кисню виразити в моль/м3). Відповідь: 79994.
128. При 250С 1 літр води розчиняє 1 літр СО2, якщо тиск СО2 дорівнює 1 атм. Визначити молярність розчину, над яким тиск СО2 при 250С дорівнює 150 мм.рт.ст. Відповідь: 8,8•10-3 моль/л.
129. Визначити зміну ентропії при змішуванні 100 г метилового спирту з 100 г етилового спирту, вважаючи що вони утворюють доскональний розчин. Відповідь: 29,85 Дж/(моль∙К).
130. С6Н6 та С2Н4Br утворюють доскональний розчин. Визначити: мольну частку бензолу в парах, якщо в розчині вона дорівнює 0,5; мольну частку бензолу в розчині, якщо в парах вона дорівнює 0,5. Тиск пари бензолу 269 мм.рт.ст., тиск пари диброметану 43 мм.рт.ст. Відповідь: 0,862; 0,138.
131. Змішали 0,2 моль речовини А та 0,5 моль речовини В при 200С. Визначити зміну ентропії та вільної енергії, якщо відомо, що речовини А та В утворюють доскональний розчин. Відповідь: 3,475 Дж/(моль∙К);
-1018,175 Дж.
132. Тиск пари розчину, що містить 13 г нелеткої розчиненої речовини в 100 г Н2О при 280С дорівнює 27,371 мм.рт.ст. Розрахувати молекулярну масу розчиненої речовини (розчин ідеальний). Тиск пари води при 280С дорівнює 28,065 мм.рт.ст. Відповідь: 92,5.
133. Відносне зниження тиску пари водного розчину, який містить нелетку речовину становить 0,04. Визначте моляльність розчину. Відповідь: 2,315 моль/кг.
134. Відносне зниження тиску пари водного розчину, який містить нелетку речовину становить 0,01. Визначте моляльність розчину. Відповідь: 0,56 моль/кг.
135. Значення похідної dP/dT насиченої пари диетилового етеру при нормальному атмосферному тиску і температурі кипіння 307,9 К дорівнює 3,53•103 Н/(м2∙К). Обчислити теплоту випаровування за рівнянням Клаузіуса-Клапейрона. Відповідь: 2,74•104 Дж/моль.
136. Питома теплота випаровування води при температурі кипіння дорівнює 2,252•103 Дж/кг. Визначити температуру кипіння водного розчину, що містить 0,02 моль нелеткої розчиненої речовини в 400 г води. Відповідь: 373,026 К.
137. Визначити температуру замерзання 10%-го водного розчину сечовини (СО(NH2)2). Кріоскопічна стала води дорівнює 1,860. Відповідь: -3,440С.
138. Знайдіть зміну тиску пари води при збільшенні температури на один градус поблизу температури кипіння при нормальному атмосферному тиску. Теплота випаровування води при температурі кипіння при тиску 101,325 кПа дорівнює 2255,1 кДж/кг. Відповідь: 3,56∙103 Па.
139. Розрахуйте молярну теплоту випаровування диетилового ефіру, що застосовується для інгаляційного наркозу, якщо поблизу температури кипіння (307,9 К) при тиску 101325 Па dp/dT = 3,53∙103 Па/К. Відповідь: 27,5 кДж/моль.
140. Визначте тиск насиченої пари пентанолу-3, що використовується у синтезі вітамінів А та Е, при 357 К, якщо при 347 К тиск насиченої пари дорівнює 43,316 кПа, а теплота випаровування його у цьому інтервалі температур становить 34,9 кДж/моль. Відповідь: 60,65 кПа.
Дата публикования: 2015-09-18; Прочитано: 1677 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
