 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Хімічна рівновага
|
|
При вивченні основних закономірностей рівноважних процесів перш за все розглядають поняття оборотних і необоротних реакцій, оберненість хімічних процесів.
Необоротними хімічними реакціями називаються реакції, які перебігають тільки в одному напрямку. З точки зору термодинаміки, у відповідності з рівнянням для енергії Гіббса необоротні процеси відбуваються із зменшенням ентальпії (-DН) і з збільшенням ентропії (+DS). Це означає, що енергія Гіббса DG при будь-яких умовах (концентрація реагуючих речовин і температура) завжди має негативне значення і реакція перебігає тільки в одному напрямку.
До необоротних реакцій належать, наприклад, реакції розкладу перманганату калія при нагріванні:
2KMnO4 = K2MnO4 + MnO2 + O2,
розклад бертолетової солі:
2KClO3 = 2KCl + 3O2
чи взаємодія лужних металів з водою
2K + 2H2O = 2KOH + H2
Та інші процеси.
Оборотними называються реакції, які можуть перебігати в прямому і зворотному напрямках. Оборотні ракції відбуваються, как правило, із зменшенням ентальпії (-DН) и ентропії (-DS) системи. З рівняння для енергії Гіббса видно, що в залежності від температури величина енергії Гіббса DG може мати негативне значння (переважає ентальпійний фактор) чи при високих температурах – позитивне значення (переважає ентропійний фактор). Для таких процесів при певних умовах можлива пряма чи зворотна реакція.
До оборотних реакцій належать, наприклад, взаємодія кисню з воднем:
2H2 + O2 Û 2H2O.
Насправді, при температурах 800 – 15000С кисень з воднем утворюють воду, взаимодіють дуже бурхливо. При температурах 3000 – 40000С, навпаки, вода розкладається з утворенням Н2 і О2. Взаємодія йода з воднем
H2 + I2 Û 2HI
Перебігає при температурі 300 – 4000С. При такій же температурі можлива й зворотна реакція розкладу йодоводню.
Більшість хімічних реакцій є оборотними. Одні реакції перебігають за умов, в яких зворотна реакція неможлива (взаємодія Н2 і О2), для інших можливий перебіг як прямої, так і зворотної реакції (взаємодія Н2 і I2). В обох наведених прикладах можна виявити зворотну реакцію і навіть визначити швидкість прямої і зворотної реакції. Існують умови, за яких одночасно перебігають пряма і зворотна реакції. Однак відомі процеси, для яких визначити швидкість зворотної реакції неможливо і тому можна тільки говорити про оборотність процесу. В якій мірі той чи інший оборотний процес залежить від природи реагуючих речовин і умов, за яких перебігає реакція?
Розглянемо більш детально оборотні реакції, які одночасно при певних умовах перебігають в двох напрямках.
aA + bB Û cC + dD
В перший момент швидкість прямої реакції
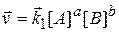
визначається початковими концентраціями вихідних речовин. Швидкість зворотної реакції при цьому дорівнює нулю. По мірі взаємодії Н2 і I2 і утворення С і D швидкість прямої реакції зменшується, а швидкість зворотної реакції

буде зростати. Через певний час швидкість прямої і зворотної реакцій зрівняються (рис.). При цьому кількість утворених молекул С і D буде дорівнювати кількості молекул С i D, які прореагували і перетворились на А і B. Тобто концентрації всіх речовин в момент, коли швидкості прямої і зворотної реакцій однакові, не змінюються. Такий стан реакційної системи називається хімічною рівновагою. При хімічній рівновазі склад системи не змінюється, оскільки в системі відбувається хімічна взаємодія в двох протилежних напрямках з одинаковою швидкістю Тому хімічна рівновага має також назву дінамічної рівноваги.

|
Стан реагуючої системи, при якому швидкості прямої та зворотної реакцій стають однаковими, називається хімічною рівновагою. У стані хімічної рівноваги кількості вихідних речовин і продуктів реакції не змінюються, тобто хімічна рівновага має динамічний характер. З появою рівноваги концентрації реагентів за даних умов залишаються незмінними й називаються рівноважними.
В момент хімічної рівноваги, коли швидкості прямої і зворотної реакції однакові, можна записати:
v1 = v2
чи

звідки

При даній температурі константи швидкостей k 1 і k 2 є сталими величинами, тому їх віношення 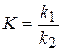 - також величина стала.
- також величина стала.
Тоді константа равновесия
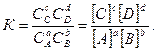
Це рівняння є математичним виразом закону діючих мас для стану рівноваги. На відміну від закону діючих мас для швидкості хімічної реакції, справедливого лише для простих одностадійних реакцій, закон діючих мас для рівноважних систем можна застосовувати для рівноважного стану будь-якої оборотної реакції незалежно від механізму її перебігу.
Константа рівноваги свідчить, що відношення добутків рівноважних концентрацій продуктів і вихідних речовин у степенях, що дорівнюють їх стехіометричним коефіцієнтам, є величиною сталою. Тобто незалежно від початкових концентрацій, рівновага в системі встановлюється завжди при тому ж співвідношенні добутків концентрацій продуктів і реагентів. Тому константа рівноваги не залежить від концентрації, а визначається природою реагентів і температурою реакції. Вона показує, у скільки разів пряма реакція відбувається швидше, ніж зворотна, за однакової температури й при концентраціях, що дорівнюють одиниці. Константа рівноваги визначає глибину проходження реакції. Чим більша константа, тим повніше взаємодіють речовини. Для необоротних реакцій К®¥, оскільки рівноважна концентрація продуктів реакції значно перевищує концентрацію вихідних речовин. Якщо К®0, то це свідчить про практично повну відсутність хімічної взаємодії. Для гетерогенних реакцій у вираз константи рівноваги входять концентрації тільки тих речовин, які перебувають у газовій або рідкій фазі. Тому для реакції СаСО3Û СаО + СО2 константа рівноваги має вигляд К= [СО2].
Константа рівноваги залежить від температури, від зміни ентальпії та зміни ентропії, але не залежить від енергії активації, яка впливає лише на час встановлення рівноваги. Тому каталізатор, знижуючи енергію активації й підвищуючи ентропію активації прямої та зворотної реакцій, прискорює встановлення рівноваги, не змінюючи її константи.
Змінюючи умови, можна перевести систему з одного рівноважного стану в інший, що відповідає новим умовам. Рівновага зміщується тому, що зміна умов неоднаково впливає на швидкість прямої та зворотної реакцій. Характер зміщення рівноваги залежно від зовнішніх факторів можна визначити за принципом Ле Шательє (1884): якщо на систему, що перебуває у стані рівноваги, впливати ззовні, то рівновага зміщується у бік тієї реакції, що послаблює цей вплив.
Згідно з принципом Ле Шательє:
Дата публикования: 2015-09-17; Прочитано: 998 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
