 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Константа швидкості – це швидкість реакції за умови, що концентрації реагуючих речовин дорівнюють 1 моль/л
|
|
Рівняння, що пов’язує швидкість реакції з концентраціями реагентів, називають рівнянням швидкості, або кінетичним рівнянням реакції.
Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники ступеню в законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер.
Розглянемо простий приклад. Фотохімічний розклад газоподібного НBr перебігає за стехіометричним рівнянням
2HBr (г) = Н2 (г) + Br2 (г).
Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул HBr. Насправді ця фотохімічна реакція здійснюється за таким механізмом:
HBr + hv = H + Br;
H + HBr = H2 + Br;
Br + Br = Br2.
Таким чином, ніякого зв’язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками ступенів в кінетичному рівнянні, зовсім немає. Схожість, що спостерігається для деяких реакцій, має випадковий характер.
Перебіг більшості хімічних реакцій такий, що утворення продуктов відбувається через ряд проміжних елементарних стадій (послідовних чи паралельних), які можна вважати елементарними реакціями. Кожна з цих реакцій описується своїм кінетичним рівнянням. В таких випадках залежність швидкості від концентрації може виявитися дуже складною. Ситуація спрощується, якщо яка-небудь з цих стадій пребігає набагато повільніше від інших. Тоді вступає в силу один з важливих принципів кінетики – принцип лімітуючої стадії: швидкість складної реакційї визначається швидкістю найповільнішої (лімітуючої) елементарної стадії.
Цей принцип ще називають принципом бутилочного горлушка, вузького місця, вузького містка, тощо. Дійсно, якщо вода виливається через систему отворів, то швидкість всього процесу буде визначатися швидкістю її проходження крізь самий вузький отвір. Середня швидкість автомобіля на жвавій автомагістралі залежить від швидкості руху через “пробки” – місця, де збирається багато машин. Якщо взвод солдат біжить крос, то результат взводу визначається швидкістю бігу найповільнішого солдату.
Сума показників ступенів в рівнянні швидкості хімічної реакції (кінетичного рівняння) є важливою характеристикою механізму процесу і називається порядком хімічної реакції. Окремі показники ступенів концентрацій реагентів визначають порядок реакції щодо даної речовини.
Визначити порядок реакції можна графічно. Наприклад, маємо кінетичне рівняння 
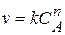 , де n-порядок реакції за речовиною А. Прологарифмуємо це рівняння отримаємо: ln v = ln k + n ln CA. Графіком цього рівняння є пряма лінія, тангенс кута нахила якої і є порядком реакції за речовиною А.
, де n-порядок реакції за речовиною А. Прологарифмуємо це рівняння отримаємо: ln v = ln k + n ln CA. Графіком цього рівняння є пряма лінія, тангенс кута нахила якої і є порядком реакції за речовиною А.
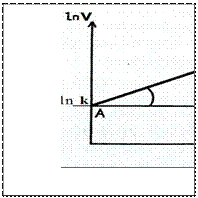
n=tgA= 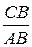
Якщо порядок нулевий (швидкість не залежить від концентрації реагуючих речовин), то v = k чи 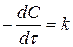 . Тоді розмірність константи швидкості моль/л×с
. Тоді розмірність константи швидкості моль/л×с
Це, наприклад, реакція розкладу кальцій карбонату: CaCO3®CaO+CO2.
Швидкість реакції першого порядку описується кінетичним рівнянням
v = k C.
Розмірність константи визначається 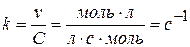
Якщо у лівій частині рівняння записати значення швидкості через зміну концентрації реагуючої речовини за одиницю часу, то отримаємо:
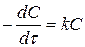 .
.
Щоб знайти залежність концентрацій реагентів від часу, потрібно розв’язати отримане диференціальне рівняння, таким чином після інтегрування ми отримаємо інтегральне рівняння для кінетичного рівняння першого порядку
ln C = ln C0 - kt (графік пряма лінія залежності lnC від t, тангенс кута нахилу якої дорівнює –k)
чи
kt = ln(C0/C).
Прикладом реакції першого порядку є розклад нітроген (V) оксиду:
N2O5 = 2NO2 + 1/2O2.
Для реакцій другого порядку кінетичне рівняння має вигляд
v = k C2; v = k CACB
Для визначення розмірності константи 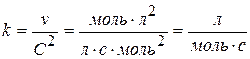
Чи інша форма записум 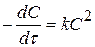 .
.
Інтегрування цього рівняння дає таку залежність концентрації речовини від часу перебігу реакції
1/C=1/C0 + kt (пряма лінія, tg a дорівнює k)
чи
kt = 1/C - 1/C0
Прикладом реакції другого порядку є взаємодія водня і йода
H2 + I2 = 2HI
розклад нітроген (IV) оксиду: 2NO2 = 2NO + O2.
Реакції третього порядку описуються кінетичними рівняннями
v = kC3 = kC12C2 = kC1C2C3.
Залежність концентрації від часу виражається рівнянням:
1/C 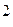 – 1/C
– 1/C 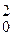 = 2kt
= 2kt
Прикладом таких реакцій є:
2NO + O2 = 2NO2;
2NO + Br2 = 2NOBr.
Порядок реакції загалом визначає характер математичної залежності швидкості реакції від концентрації реагентів. Порядок реакції, тобто сума показників ступенів в кінетичному рівнянні, як правило, може приймати дробові значення.
Елементарний акт реакції відбувається внаслідок зіткнення молекул. Для характеристики механізму реакцій застосовують поняття молекулярності реакції.
Число молекул, які беруть участь в елементарному акті реакції, називають молекулярністю реакції.
Реакція, для перебігу якої необхідна тільки одна молекула, называється мономолекулярною реакцією. Це реакція розкладу чи перегрупування, наприклад:
I2 = 2I;
HBr = H + Br;
N2O5 = 2NO2 + 1/2O2.
Для бімолекулярної реакції для елементарного акту потріюна наявність двох часток (молекул, іонів, атомів):
H2 + I2 = 3HI.
В тримолекулярній реакції реагують одночасно три молекули (ці реакції трапляються дуже рідко):
2NO + O2 = 2NO2.
Реакція, молекулярність яких більше трьох, не буває, оскільки одночасно зіткнення в одній точці чотирьох і більше молекул малоймовірно. Фактично всі елементарні хімічні реакції є мономолекулярними чи бімолекулярними, тобто всі реальні хімічні реакції дуже прості, не враховуючи іноді складності сумарних стехіометричних рівнянь. Таким чином, сумарна форма рівняння хімічної реакції не відоюражає складності і багатостадійності процесу, який може складатися з декількох елементарних реакцій різного порядку.
Наприклад, для реакцій:
2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O;
2C4H10 + 13O2 = 8CO2 + 10H2O
Суми коефіцієнтів перед формулами вихідних речовин дорівнюють відповідно 18 і 15, але це не означає, що в елементарних актах цих реакцій беруть участь такі кількості молекул. Такі реакції відбуваються за багатьма стадіями, кожна з яких моно- чи бімолекулярна.
Завдання. Написати кінетичні рівняння для реакцій (закон действующих масс)
а)СaO(к) + СО2(г) = СаСО3(к);
б)В2Н6(г) + 6Сl2(г) = 2ВСl3(г) + 6НСl;
в)2SO2(г) + О2(г) = 2SO3(г);
г)NH4Cl(к) = NH3(г) + HCl(г).
Дата публикования: 2015-09-17; Прочитано: 4647 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
