 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Різницю енергій перехідного стану і вихідних речовин називають енергією активації, або потенціальним бар'єром, реакції
|
|
Іншими словами, енергія активації — це найменша енергія, потрібна для такого послаблення зв'язків у вихідних молекулах, після якого енергія утворення нових зв'язків переважає затрати енергії для подальшого послаблення вихідних зв'язків. Утворення перехідного стану — процес енергетичне вигідніший, ніж повний розрив зв'язків у вихідних молекулах. Для більшості реакцій енергія активації менша за енергію, потрібну для розриву навіть найслабкішого зв'язку у вихідних молекулах.
Отже, у хімічному перетворенні можуть брати участь не всі молекули, а тільки так звані активні, тобто ті, що мають енергію, достатню для утворення перехідного стану.
Енергія активації DЕакт – важливая характеристика хімічних перетворень. Саме енергія активації затримує чи робить неможливими багато реакцій, які з точки зору термодинаміки можуть перебігати самочинно. Якщо б енергія активації для всіх реакцій дорівнювала нулю, то в природі відбувалася безлічь хаотичних хімічних, реакцій, для яких DG негативна. Так, вугілля і нафта при контактв з повітрям загоралися б, азот повітря і вода утворювали б розчин нітратної кислоти, живі б клітини зруйнувалися внаслідок гідролізу.
Таким чином, існування більшості молекул, кристалічних речовин і навіть живі клітини можливо тому, що процеси їх перетворення і руйнування пов’язані з подоланням значного енергетичного бар’єра.
Підвищення температури реагуючих часток внаслідок зростання швидкості молекул зумовлює зростання загальної енергії системи і відповідно збільшення відносного вмісту активних молекул, що рівноцінно зростанню швидксоті хімічної реакції. Вплив температури і енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і енергії активації Еакт:
 ,
,
або у логарифмічній формі

де А – множник Арреніуса чи частотний фактор, пропорційний числу зіткнень молекул.
Якщо концентраці реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса надає можливість виразити залежність швидкості реакції від температури:
v 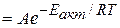 .
.
Оскільки у рівнянні температура входить в показник ступеню, то швидкість хімічних реакцій в значній мірі залежить від зміни температури.
Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: з підвищенням температури на кожні 10 градусівшвидкість реакції зростає в 2-4 рази.
В математичній формі правило Вант-Гоффа записується так:
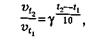
де D t – різниця (зростання) температур; v1 – швидкість реакції до підвищення температури; v2 – швидкість реакції після підвищення температури (при температурі t 2); g - температурний коефіцієнт швидкості реакції (g=2…4).
Дата публикования: 2015-09-17; Прочитано: 265 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
