 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
III Методы анализа аминокислот
|
|
Распределительная хроматография аминокислот
Распределительная хроматография – метод анализа аминокислот и их смесей. Задача анализа смесей аминокислот часто встречается в случае анализа (экспертизы качества, определения подлинности) лекарственных препаратов, биологически активных добавок, продуктов питания и кормов. В последних двух случаях этот анализ также необходим для определения пищевой ценности. В биохимической исследовательской практике хроматография аминокислот применялась для определения аминокислотного состава белков и исследования обмена веществ.
Метод распределительной хроматографии используется для разделения аминокислот. В основе метода лежит тот факт, что аминокислоты имеют разную растворимость в разных растворителях. В распределительной хроматографии всегда используется два растворителя, не смешивающихся друг с другом. Эти растворители называют «фазы». Для анализа разных веществ используются разные фазы и их сочетания, а выбор фаз зависит от структуры разделяемых веществ. Тем не менее, для одного анализа всегда нужно только две фазы. В случае распределительной хроматографии на бумаге или силикагеле одной из фаз является вода, другой – органический растворитель (или их смесь), насыщенный водой. Вода в данном случае неподвижна (неподвижная фаза), так как сорбирована (неподвижно закреплена) на инертном носителе (целлюлозе, силикагеле), который в атмосферном воздухе удерживает до 15% воды, оставаясь внешне сухим. Насыщенный водой органический растворитель (подвижная фаза) перемещается относительно неподвижной фазы за счет капиллярного эффекта. Чем больше растворимость аминокислот в воде (неподвижной фазе) и меньше в органическом растворителе (подвижной фазе), тем медленнее движется аминокислота по носителю. При этом аминокислоты перемещаются по носителю за счет движения подвижной фазы.
Выполнение метода сводится к тому, что на хроматографическую бумагу или силикагель (инертный носитель) в одну точку наносят исследуемый раствор смеси аминокислот и высушивают. Бумагу или пластинки с силикагелем приводят в контакт со смесью органических растворителей, которые вследствие капиллярного эффекта перемещаются по носителю. По мере продвижения растворителя смесь аминокислот будет разделяться, причем те из них, которые растворяются в органическом растворителе больше, продвигаются вдоль носителя дальше, чем те, что растворяются меньше. Когда фронт растворителя приближается к противоположному краю носителя, процесс прекращают и бумагу или пластинку с силикагелем высушивают. Аминокислоты, на полученной таким образом хроматограмме, обнаруживают с помощью реагента, дающего с аминокислотами цветную реакцию. Отдельные аминокислоты обнаруживаются в виде цветных пятен, расположенных на разных расстояниях от места нанесения исследуемой смеси.
Скорость перемещения отдельных аминокислот может быть выражена посредством величины их хроматографической подвижности (R f). Хроматографической подвижностью называется отношение расстояния от места нанесения аминокислоты до середины её пятна к расстоянию от места нанесения аминокислоты до фронта растворителя:
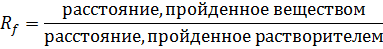
Величина Rf является характерной величиной для каждой аминокислоты и постоянна при данных условиях опыта (растворитель, температура, носитель и др.).
Наиболее часто идентификация аминокислот на хроматограммах проводится путем использования чистых аминокислот – «стандартов», наносимых на ту же хроматограмму.
Распределительная хроматограмма может быть выполнена несколькими способами. Ниже приводится два способа такой хроматографии.
В качестве отчета о проделанной работе:
1. Заполните таблицу
| Носитель | Rf | ||
| аспарагиновая кислота | пролин | изолейцин | |
| хроматографическая бумага | |||
| силикагель |
2. Приложите полученные хроматограммы
3.1 Радиальная хроматография
Нанесение раствора на хроматографическую бумагу:
Берут беззольный фильтр из быстрофильтрующей бумаги диаметром 11-14 см. Фильтр перегибают по диаметрам, перпендикулярным друг другу. В точке пересечения линий сгиба (центр фильтра) вырезают отверстие диаметром около 3 мм. На расстоянии около 1 см от центрального отверстия простым карандашом отмечают точки. В эти точки при помощи калиброванных стеклянных капилляров объемом 5 мкл наносят исследуемые растворы. В каждую точку наносят один полный капилляр. В одну из точек наносят исследуемую смесь аминокислот. В оставшиеся точки наносят растворы аминокислот – «стандартов», входящих в смесь: пролина, аспарагиновой кислоты, изолейцина. После нанесения каждой капли раствора бумагу просушивают в токе теплого воздуха и лишь затем наносят следующую каплю. Каплю наносят с расчетом, чтобы пятно от неё не превышало 3 мм по диаметру. После нанесения подписывают простым карандашом у наружного края диска что и где было нанесено. Для нанесения используют растворы аминокислоты пролина, аспарагиновой кислоты, изолейцина по 5 мг/мл в 0,5 н. НCl и их равнообъемную смесь. Хроматограмму тщательно высушивают.
Проведение хроматографии:
Из второго фильтра вырезают полоски шириной около 1,5 см, длиной 5-7 см. Эти полоски сворачивают в как можно более тонкие трубочки, которые затем вставляют в центральное отверстие дисков (делают фитиль). Хроматограмму с фитилем помещают между двумя половинками чашек Петри с одинаковым диаметром, образующими хроматографическую камеру, так, чтобы фитиль хроматограммы был погружен в систему растворителей, которую наливают в нижнюю чашку. В качестве системы растворителей используют: н-пропанол-аммиак-вода в объемном отношении 6:3:1. Хроматографическое разделение проводят при комнатной температуре в течение 30 -40 мин.
Насыщенный водой растворитель впитывается фитилем и движется по бумажному диску, увлекая нанесенные вещества. Этот приводит к разделению исследуемой смеси на отдельные аминокислоты, соответственно коэффициентам их хроматографической подвижности
Обнаружение аминокислот:
По истечении 30-40 мин, когда фронт растворителя пройдет путь около 4-5 см, хроматограмму извлекают из камеры, тщательно сушат в течении 4-5 мин в потоке воздуха при температуре 60-80С для удаления растворителя. После этого хроматограмму опрыскивают из пульверизатора раствором нингидрина в ацетоне и помещают в поток горячего воздуха на 5 минут при температуре 80С. На хроматограмме появляются цветные пятна. Каждое пятно соответствует отдельной аминокислоте (желтое – пролин, серо-синее – аспарагиновая кислота, красно-фиолетовое – изолейцин). Сопоставляя положение пятен исследуемого раствора с положением пятен «стандартов», определяют наличие тех или иных аминокислот в исследуемой смеси (рис. 9)
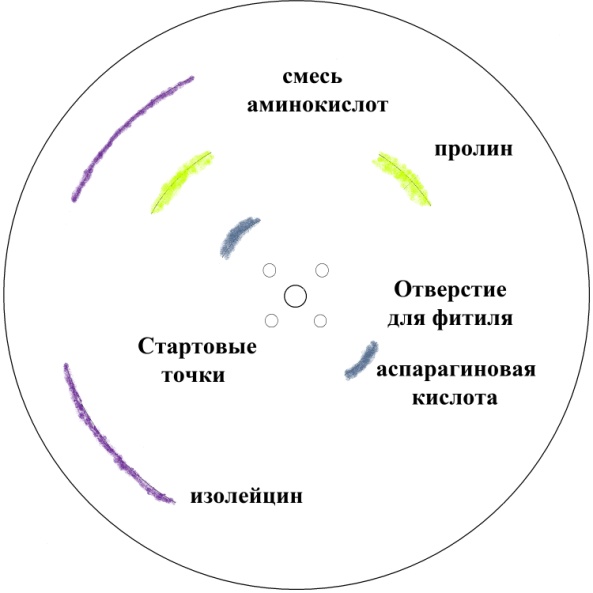
Рис. 9. Радиальная хроматограмма
3.2 Тонкослойная хроматография
Для тонкослойной хроматографии аминокислот используют готовые коммерческие пластинки. В качестве подложки для изготовления этих пластинок используется алюминиевая фольга. На ней нанесен тонкий слой крупнопористого силикагеля, связанный золем кремниевой кислоты, для придания этому слою большой механической прочности.
Из выданного листа 20х20 см вырезать пластинку 5х5 см. На пластинке отметить 4 стартовые точки на расстоянии 1 см от края. На одну из этих точек наносят смесь аминокислот, а на остальные – отдельные аминокислоты в качестве «стандартов». Растворы аминокислот наносят, как описано для радиальной хроматографии, но зону нанесения растягивают в небольшую горизонтальную полоску длиной 3-5 мм (рис. 10).
После тщательного высушивания нанесенных пятен, хроматографическую пластинку помещают в хроматографическую камеру. Конец пластинки погружают на 0,5 см в систему растворителей таким образом, чтобы места нанесения аминокислот остались над растворителем. Хроматографию проводят при комнатной температуре в течение 20-30 мин, пока фронт растворителя полностью не пройдет всю пластинку. После этого пластинку вынимают из камеры, отмечают положение фронта растворителя, высушивают, опрыскивают нингидрином и проявляют в токе горячего воздуха, как описано для радиальной хроматографии.
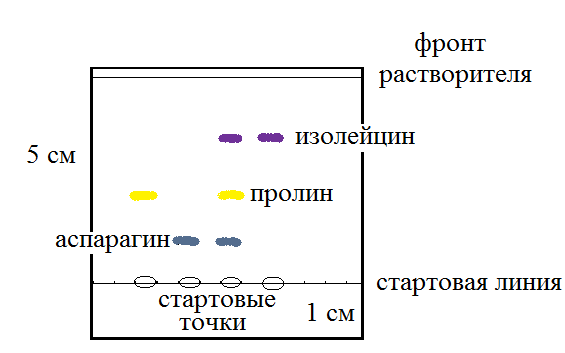
Рис. 10. Тонкослойная хроматограмма
3.3 Определение содержания аминокислот формольным титрованием
Метод формольного титрования (или титрование по Сёренсену) применяется для определения количество аминокислот, присутствующих в образце. Определение аминокислот используется для контроля качества лекарств, пищевых добавок и кормовых смесей, культуральных сред в микробиологии и биотехнологии (в том числе культуре ткани клеток растений и животных), также определение аминокислот необходимо для контроля качества сырья и химических технологических процессов.
Суть формольного титрования состоит в том, что аминогруппы аминокислот блокируются формальдегидом, а оставшиеся свободные карбоксильные группы титруют щелочью:

По количеству пошедшей на титрование щелочи определяют количество СООН-групп. В среднем число карбоксильных групп в аминокислотах принимают равным числу аминогрупп (что вполне справедливо для моноаминокислот, для диаминокислот вводятся соответствующие поправки в методику титрования). Также формольным титрованием могут определяться соли аммония (присутствие которых в пробе будет мешать определению аминокислот).
В данной работе вам предлагается определить содержание аминокислоты L-глицина (моль-масса 75,1 г/моль) в лекарственном препарате (таблетки «Глицин-Био»).
В качестве отчета о проделанной работе:
1. Запишите схемы реакций
2. Заполните таблицу
| масса пустого стакана(г): | |
| масса стакана с таблетками (г): | |
| масса таблеток (г): | |
| объем щелочи, пошедший на титрование(мл): | |
| опытной пробы | контрольной пробы |
| 1. | 1. |
| 2. | |
| 3. | |
| среднее | среднее |
| масса глицина в одной таблетке (мг): |
3. приведите расчет содержания глицина в одной таблетке по формуле.
Для количественного определения аминокислот методом формольного титрования приходится пользоваться микробюретками в связи с малым количеством анализируемого вещества. Микробюретки позволяют проводить достаточное точное титрование при объемах титранта от 0,5 до 5 мл. Наиболее часто используется микробюретка Банга (рис. 11)
Приступая к работе с микробюреткой необходимо заполнить титрантом резервуар 1, а затем удалить все воздушные пузыри из трубки для заполнения бюретки и её мерного колена, поочередно открывая и закрывая краны 3 и 4. При этом стоить быть осторожным: не допускать переполнения мерного колена и выплескивания титранта, а также опорожнения резервуара 1 так как последнее приводит к необходимости повторно выгонять воздушные пузыри из бюретки. Затем бюретку необходимо троекратно промыть раствором титранта путем заполнения и опорожнения мерного колена. По окончании работы бюретку необходимо трижды промыть дистиллированной водой. Оставлять титрант в бюретке нельзя, так как это приводит к заеданию кранов и выходу бюретки из строя (особенно, если титрант – раствор щелочи)
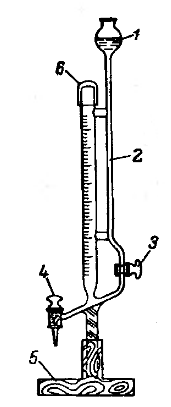
Рис. 11. Микробюретка Банга.
1-резервуар для титранта, 2- трубка для заполнения бюретки, 3 – кран для заполнения бюретки, 4 – кран для титрования, 5 – подставка, 6 – мерное колено бюретки.
Ход работы:
На аналитических весах взвесить стакан объемом 100 мл
Поместить в стакан 2 таблетки глицина по 100 мг, взвесить стакан вторично
По разнице масс определить массу таблеток.
Внести в стакан 50 мл дистиллированной воды, при помощи мерного цилиндра. Растворить таблетки, при перемешивании стеклянной палочкой.
Профильтровать раствор через складчатый фильтр в мерную колбу
Обмыть стаканчик и палочку дистиллированной водой трижды (примерно по 10 мл). Промывные воды также профильтровать в мерную колбу
Довести дистиллированной водой до метки. Перемешать
Провести контрольное титрование:
Пипеткой Мора отобрать 10 мл дистиллированной воды в коническую колбу объемом 25 мл.
Пипеткой мора прилить 5 мл формольной смеси.
Титровать ~0,1 н. раствором едкого натра из микробюретки до слабо-розовой окраски.
Записать объем щелочи, пошедший на контрольное титрование.
Титрование проводится трижды.
Затем провести опытное титрование следующим образом: к 10 мл полученного раствора таблеток прилить 5 мл формольной смеси и титровать ~0,1 н. раствором едкого натра из микробюретки до слабо-розовой окраски.
Записать объем щелочи, пошедшей на опытное титрование.
Титрование проводится трижды.
Рассчитать количества глицина Х (мг) в 1 таблетке по следующей формуле:
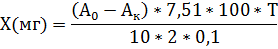
где А0 и Ак – количество 0,1 н. раствора гидроксида натрия, пошедшего на титрование опытной и контрольной проб соответственно, мл; 7,51 – количество глицина (мг), соответствующее 1 мл 0,1 н. раствора гидроксида натрия (1 мл нормального раствора щелочи соответствует 75,1 мг глицина азота); 100 – общий объем раствора для анализа, мл; 10 – объем раствора, взятого для титрования, мл; 2 – количество таблеток, взятых на анализ; Т/0,1 – нормальность раствора едкого натра деленная на 0,1.
Точное значение нормальности раствора едкого натра сообщает преподаватель.
Вопросы для самоподготовки
В чем практическое значение формольного титрования?
На каких реакциях основано формольное титрование?
На каком принципе основана распределительная хроматография аминокислот?
Что такое фаза?
В чем разница между подвижной и неподвижной фазами?
Что такое хроматографическая подвижность, от чего она зависит?
Что такое R f, запишите выражение для этой величины?
С помощью какой реакции обнаруживают аминокислоты на хроматограммах?
В чем практическая значимость распределительной хроматографии аминокислот?
Дата публикования: 2015-09-17; Прочитано: 6616 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
