 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Работа с автоматической пипеткой
|
|
Автоматическая пипетка – основной инструмент при работе в современной биохимической лаборатории.
Автоматическая пипетка предназначена для дозирования водных растворов низкой вязкости при комнатной температуре – только в этом случае объем, выставленный на пипетке, равен объему жидкости в типе.
Устройство и принцип действия автоматической пипетки представлены на рисунке 1. Автоматическая пипетка состоит из корпуса 3, зажимаемого в руке, с упором для указательного пальца 2. Набор и выдавливание жидкости из пипетки происходит путем нажимания большим пальцем на поршень 1. При надавливании поршень смешается, пока не достигнет первого упора, при большем усилии поршень смещается еще немного и достигает второго (окончательного) упора. Смещение поршня, а следовательно, и набираемый в пипетку объем жидкости регулируется вращением колеса 6, а установленный объем показывается в окне индикатора 4. Набор жидкости происходит непосредственно в сменный наконечник 5, называемый типом. Удаление использованного типа производится нажатием большим пальцем на кнопку 7, которая приводит в действие рычаг 8, непосредственно сталкивающий тип с носика пипетки.

Рис. 1. А-устройство автоматической пипетки, Б- принцип действия
Автоматическая пипетка работает аналогично медицинскому шприцу: внутри корпуса пипетки 9 находится стальной поршень 11, который с помощью уплотнительного резинового кольца 10 и силиконовой смазки герметично с ним соединен. При смещении поршня 11 вверх, в тип, надетый на пипетку, втягивается жидкость, при смещении поршня вниз – жидкость выдавливается. Регулируя колесом 6 ход поршня – регулируется объем всасываемой жидкости.
Автоматическая пипетка плохо подходит для дозирования:
1.Вязких жидкостей (глицерина, агара, концентрированной серной кислоты, триэтаноламина, концентрированных растворов детергентов и белков)
2.Жидкостей с низким поверхностным натяжением, особенно при повторных заборах (детергенты, растворы белков);
3.Холодных и горячих растворов, так как воздух в типе меняет температуру, и, следовательно, объём (охлажденные растворы ферментов, горячие буферы для гибридизации, верхний агар).
4.Органических растворителей (особенно легколетучих, например хлороформа, ацетона, диэтилового эфира)
Во всех этих случаях точность дозирования резко падает, для точного дозирования всех указанных растворов приходится применять специальные приемы
Автоматическая пипетка не подходит для дозирования:
1.Агрессивных жидкостей (концентрированная серная и хлорная кислоты, пергидроль)
2.Жидкостей и растворов, выделяющих агрессивные пары (концентрированная соляная, плавиковая и азотная кислоты, жидкий бром)
В этих случаях возможна порча пипетки
Правила работы с пипеткой:
1. Отжать поршень пипетки до первого упора
 2. При отборе жидкости, боковыми стенками типа не касаться боковых стенок сосуда (часто тип укрепляют на пипетке руками, поэтому его внешняя поверхность загрязнена, также на внешнюю поверхность может налипнуть жидкость со стенок сосуда, что приведет к неточному дозированию).
2. При отборе жидкости, боковыми стенками типа не касаться боковых стенок сосуда (часто тип укрепляют на пипетке руками, поэтому его внешняя поверхность загрязнена, также на внешнюю поверхность может налипнуть жидкость со стенок сосуда, что приведет к неточному дозированию).
3.Жидкость отбирать прямо с поверхности, тип глубоко не опускать.
4.Отпускать поршень пипетки вверх необходимо плавно (иначе раствор попадет внутрь пипетки, что приведет к её порче).
5.Выдавить жидкость, отжав пипетку до второго упора.
6.Жидкость выдавливать, по возможности, на стенку пробирки или на поверхность жидкости – не капать и не погружать тип глубоко.
6.Не класть пипетку с надетым типом на стол - тип может загрязниться/кого-нибудь испачкать; если в типе осталась больше 50µl жидкости, то она может затечь внутрь пипетки. Растворы с низким поверхностным натяжением (растворы белков, детергентов, фенол, хлороформ, спирт) способны затечь в горизонтально лежащую пипетку, даже если их в типе гораздо меньше, чем 50µl.
7.Не сбрасывать тип, в котором есть жидкость – эта жидкость также может попасть внутрь пипетки.
8.Следите, чтобы выставленный на пипетке объем не сбился в ходе работы.
9.Не выставляйте на пипетке объем выше ее номинала.
10.Следует контролировать работу пипетки "на глаз", особенно при повторных дозированиях (часто случается, что отбирается неправильный объём - некачественный тип, тип неплотно одет, тип не сразу коснулся жидкости, тип закупорился).
1.1 Реакция Фоля
Реакция Фоля доказывает наличие серы в составе белков.
При добавлении к раствору белка концентрированного раствора щелочи и уксуснокислого свинца с последующим кипячением наблюдается потемнение раствора. Реакция обусловлена присутствием в белке серосодержащих кислот: цистеина и метионина. Эти аминокислоты при нагревании в присутствии концентрированной щелочи разрушаются, образуя сернистый натрий.
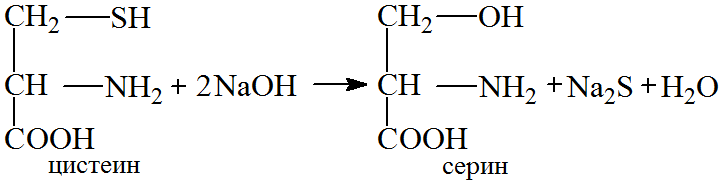
Уксуснокислый свинец взаимодействует с избытком едкой щелочи с образованием тетрагидроксоплюмбата(II) натрия
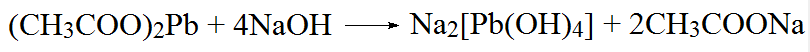
Сернистый натрий при взаимодействии с тетрагидроксоплюмбатом(II) натрия образует черный осадок сернистого свинца

Ход работы:
В одну пробирку вносят 0,5 мл 1%-ного раствора яичного белка, во вторую – 0,5 мл 1%-ного раствора желатина. В каждую пробирку добавляют по 0,5 мл 30%-ного раствора гидроксида натрия и по 50 мкл 5%-ного раствора уксуснокислого свинца. Нагревать на спиртовке. При интенсивном кипячении жидкость с яичным белком темнеет, образуя черный осадок сернистого свинца. В пробирке с желатиной черного осадка не образуется, так как желатин почти не содержит серосодержащих аминокислот.
1.2 Реакция Адамкевича
Реакция Адамкевича демонстрирует присутствие аминокислоты триптофана в составе белка. При добавлении к раствору белка незначительных количеств глиоксиловой кислоты в присутствие крепкой серной кислоты получается красно-фиолетовое окрашивание.
Реакция основана на способности триптофана в кислой среде взаимодействовать с альдегидами, образуя при этом окрашенные продукты конденсации
Глиоксиловая кислота всегда присутствует в небольших количествах в ледяной уксусной кислоте, поэтому последнюю используют в реакции Адамкевича, как источник глиоксиловой кислоты
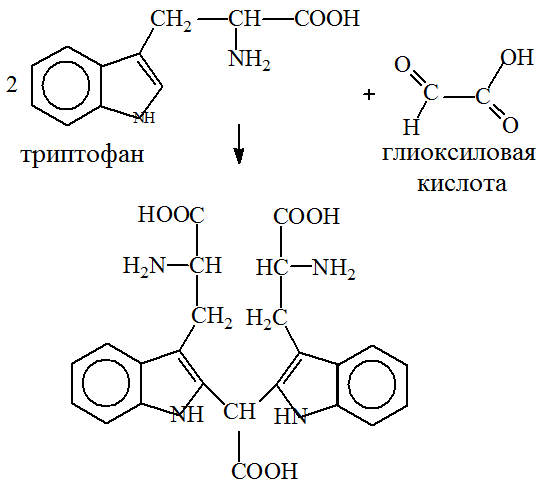
Ход работы
В одну пробирку наливают 0,5 мл 1%-ного раствора яичного белка, во вторую – 0,5 мл 1%-ного раствора желатина. В каждую пробирку добавляют примерно по 0,5 мл концентрированной уксусной кислоты. Раствор сначала нагревают, затем охлаждают и по стенке пробирки осторожно, чтобы жидкости не смешивались (подслоение) прибавляют 5 капель концентрированной серной кислоты. При стоянии в пробирке с яичным белком на границе двух слоев жидкости наблюдается красно-фиолетовое окрашивание в виде кольца. Появление окраски можно ускорить, поместив пробирку в кипящую водяную баню. В пробирке с раствором желатина окрашивание не происходит, так как этот белок не содержит триптофана.
1.3 Реакция Сакагучи
Реакция Сакагучи позволяет открывать гуанидиновую группировку. Гуанидиновая группировка входит в состав аминокислоты аргинина, по этой причине белки также дают положительную реакцию Сакагучи. Белки в присутствии щелочи дают красное окрашивание с гипобромитом и α-нафтолом.
Механизм реакции Сакагучи не известен. Вероятно, гуанидиновая группировка окисляется гипобромитом и окисленный аргинин, соединяясь с α-нафтолом, образует продукт конденсации красного цвета

Ход работы
В одну пробирку наливают 0,5 мл 1%-ного раствора яичного белка, в другую – 0,5 мл 1%-ного раствора желатина. Затем, в каждую пробирку добавляют по 0,5 мл 10%-ного раствора гидроксида натрия, по 3 капли 0,1%-ного спиртового раствора α-нафтола и 0,5 мл 2%-ного раствора гипобромита натрия. Жидкость в пробирке с раствором яичного белка приобретает красный цвет.
1.4 Ксантопротеиновая реакция
Ксантопротеиновая реакция указывает на присутствие в белке ароматических радикалов, которые входят в состав аминокислот фенилаланина, тирозина, триптофана. При добавлении к раствору бека концентрированной азотной кислоты белок сначала выпадает в осадок, а затем, при нагревании, растворяется и жидкость окрашивается в желтый цвет.
Реакция характерна для бензольного ядра циклических аминокислот, которые при обработке концентрированной азотной кислотой подвергаются нитрованию:
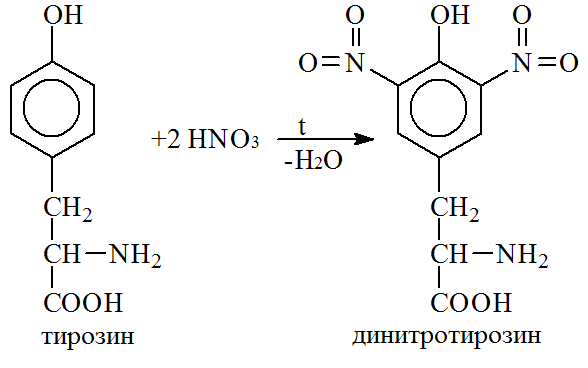
Нитропроизводные аминокислот в щелочной среде, например при добавлении водного раствора аммиака, образуют соли хиноидной структуры, окрашенные в оранжевый цвет.
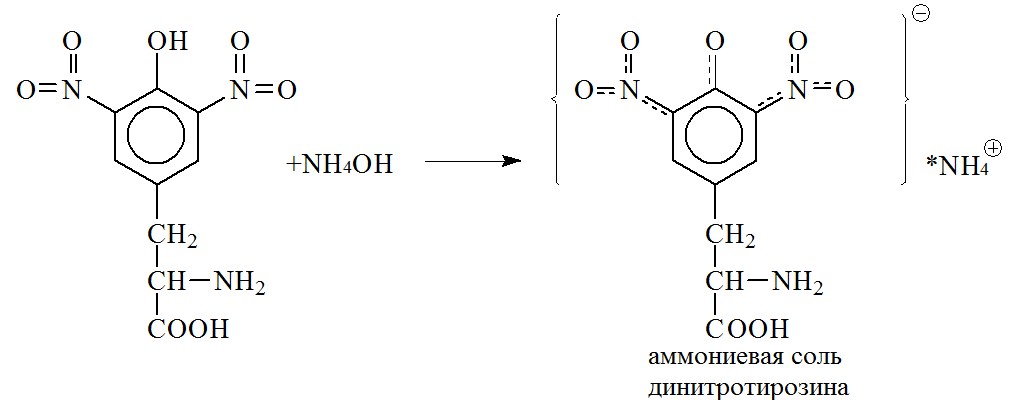
Аналогично протекает реакция нитрования триптофана и фенилаланина, последний нитруется труднее. Ксантопротеиновую реакцию дают практически все белки, за исключением желатина и нескольких других белков, в молекулах которых почти полностью отсутствуют ароматические аминокислоты.
Очень похожа на ксантопротеиновую реакцию реакция Милона – их механизм полностью аналогичен. Различия заключаются лишь в том, что из всех ароматических аминокислот в реакцию Милона вступает только тирозин, а получение оранжевого (красно-коричневого в случае реакции Милона) солеобразного соединения здесь происходит в одну стадию, а не в две как в ксантопротеиновой теакции. Реактив Милона представляет собой раствор нитрата ртути (II) в концентрированной азотной кислоте.
Ход работы:
В одну пробирку наливают 0,5 мл 1%-ного раствора яичного белка, во вторую 0,5 мл 1%-ного раствора желатина. В обе пробирки добавляют по 3 капли концентрированной азотной кислоты (ОСТОРОЖНО!), нагревают на спиртовке до кипения. В пробирке с яичным белком жидкость окрашивается в лимонно-желтый цвет, а в пробирке с желатиной появляется едва заметное бледно-желтое окрашивание, обусловленное незначительной примесью других белков. Пробирки охлаждают, после этого в них осторожно добавляют по 1,0 мл 30%-ного раствора гидроксида натрия. В пробирке с яичным белком окраска переходит в оранжевую.
1.5 Нингидриновая реакция
Нингидриновая реакция позволяет обнаружить свободные аминогруппы. Кроме α-аминогрупп, входящих в состав пептидной связи, в молекуле белка присутствуют свободные аминогруппы, входящие в состав боковых радикалов аминокислот (например, лизина, глутамина). В результате добавления к растворам белков и пептидов раствора нингидрина (трикетогидриндегидрата) при нагревании развивается синее или фиолетовое окрашивание. Реакция протекает в две стадии.
На 1-й стадии образуется восстановленный нингидрин за счет окислительного дезаминирования и декарбоксилирования аминокислот. Также на этой стадии образуется аммиак.

На 2-й стадии реакции образовавшийся аммиак реагирует с эквимолярным количеством окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт конденсации (пурпур Руэмана) с максимумом поглощения при 540 нм (для пролина при 440 нм, окрашивание желтое).

Интенсивность окраски пропорциональна количеству аминогрупп, поэтому реакция может быть использована для количественного определения аминокислот. Также нингидриновая реакция используется для обнаружения аминокислот в хроматографии.
Ход работы:
В одну пробирку вносят 0,5 мл 1%-ного раствора яичного белка, в другую – 0,5 мл 1%-ного раствора желатины. В каждую пробирку добавляют по 0,2 мл 0,4%-ного раствора нингидрина и нагревают до кипения на спиртовке. Через 2-3 минуты в обеих пробирках появляется розовое, красное, а затем сине-фиолетовое окрашивание.
1.6 Обнаружение отпечатков пальцев на бумаге
Кожа человека практически всегда покрыта тонким слоем пота и кожного сала, выполняющим защитную функцию и усиливающие барьерные свойства кожи. Так же кожа (а именно её наружный слой – эпидермис) покрыта слоем омертвевших клеток, содержащих большое количество белка. При контакте кожи человека с окружающими предметами небольшие количества пота, кожного сала и омертвевших клеток неизбежно остаются на них. Обнаружение таких следов, оставленных пальцами рук человека, широко используется в криминалистике.
Для обнаружения отпечатков пальцев на бумаге и документах с успехом может быть использована нингидриновая реакция. В результате которой следовые количества белков кожи окрашиваются в синий цвет.
Ход работы:
Вытянуть большой палец (или любой другой по выбору) правой руки испытуемого, согнув остальные пальцы руки в кулак. Помощник, тремя пальцами левой руки (большим, указательным, средним) берет нужный палец руки испытуемого у основания (ближе к ладони), а одноименными пальцами своей правой руки берет верхнюю фалангу этого же пальца испытуемого. Затем палец испытуемого боковой стороной ногтевой фаланги пальца руки кладется на край листа бумаги (использовать бумагу для принтера) и прокатывается по ней слева направо, от одной кромки ногтя до другой.
Бумагу с отпечатками пальцев обрызгивают 0,4 %-ным раствором нингидрина в ацетоне из пульверизатора до полного увлажнения. Обрызганный лист поместить нагревают над нагретой электроплиткой (3-5 см от поверхности) до появления синих отпечатков пальцев.
1.7 Биуретовая реакция
Биуретовая реакция открывает наличие пептидной (амидной) связи. Так как аминокислоты в белках соединены пептидными связями, все белки дают положительную биуретовую реакцию. В результате прибавления к раствору белка едкой щелочи и солей меди (II) раствор приобретает фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле белка. Такую реакцию дают все белки, а также продукт их неполного гидролиза – пептоны и полипептиды, содержащие не менее двух пептидных связей.
Группа, образующая пептидную связь (-CO-NH-), в щелочной среде претерпевает таутомерные превращения и присутствует в своей енольной форме (тогда как в кислой и нейтральной среде пептидная связь находится в кето-форме).

Ионы меди образуют ковалентные и дополнительные координационные связи с атомами азота, находящимися в составе пептидной связи, путем использования их не поделенных электронных пар. Возникающий таким образом комплекс очень стабилен и окрашен в интенсивный синий цвет. По другой гипотезе при избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью, возникает солеобразная связь. Правда, вероятно, лежит где-то посередине.
Схематично реакцию можно представить так:

Интенсивность синей окраски зависит от концентрации белка и количества медной соли в растворе. По этой причине биуретовая реакция используется для количественного определения белков.
Ход работы:
В одну пробирку добавляют 0,5 мл 1%-ного раствора яичного белка, в другую – 0,5 мл 1%-ного раствора желатина. В каждую пробирку добавляют по 1 мл 10%-ного раствора гидроксида натрия и по 100 мкл 1%-ного раствора сульфата меди. В той и другой пробирке появляется красно-фиолетовое (или сине-фиолетовое) окрашивание.
Вопросы для самоподготовки
В чем суть биуретовой реакции, что она позволяет обнаружить?
Каково практическое значение биуретовой реакции?
Что обнаруживают с помощью нингидриновой реакции?
Практическое значение нингидриновой реакции?
В основе каких качественных реакций лежит реакция нитрования ароматических аминокислот?
Что обнаруживается с помощью реакции Сакагучи?
С помощью каких реакций можно обнаружить ароматическую аминокислоту триптофан?
Что открывают с помощью реакции Фоля?
Почему разные белки по разному ведут себя в реакции Фоля?
Дата публикования: 2015-09-17; Прочитано: 4609 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
