 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретична частина. Природня радіоактивність була відкрита в 1896 р
|
|
Природня радіоактивність була відкрита в 1896 р. французьким ученим А.Беккерелем. В даний час відомо близько трьох тисяч радіоактивних ізотопів. Радіоактивністю називається самостійне перетворення одних атомних ядер на інші, що супроводжується випусканням елементарних частинок. Такі перетворення зазнають тільки нестабільні ядра. До радіоактивних процесів належать:
1) α-розпад;
2) β-розпад (зокрема електронне захоплення);
3) γ-випромінення ядер;
4) спонтанне ділення важких ядер;
5) протонна радіоактивність.
Радіоактивність, що спостерігається у ядер, існуючих в природних умовах, називається природньою. Радіоактивність ядер, отриманих за допомогою ядерних реакцій, називається штучною. Між штучною і природньою радіоактивністю немає принципової різниці. Процес радіоактивного перетворення в обох випадках підкоряється однаковим законам.
Окремі радіоактивні ядра зазнають перетворення незалежно один від одного. Тому можна вважати, що кількість ядер dN, які розпадаються за малий проміжок часу dt, пропорційна як числу наявних ядер N, так і проміжку часу dt:
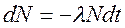 (1)
(1)
де  - коефіцієнт пропорційності, який називається постійною розпаду даного елементу і визначає імовірність того, що атом радіоактивної речовини зазнає перетворення за одиницю часу. Знак мінус указує на зменшення числа атомів радіоактивного елементу з часом.
- коефіцієнт пропорційності, який називається постійною розпаду даного елементу і визначає імовірність того, що атом радіоактивної речовини зазнає перетворення за одиницю часу. Знак мінус указує на зменшення числа атомів радіоактивного елементу з часом.
Розділимо змінні і проінтегруємо вираз (1):
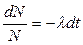
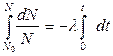
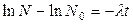 (2)
(2)


N 0 – початкова кількість ядер в момент часу t =0
N –кількість ядер, що залишилися у момент часу t.
Співвідношення (2) називається законом радіоактивного розпаду.
Однією з основних: характеристик радіоактивних ізотопів є період напіврозпаду. Періодом напіврозпаду Т називають проміжок часу, протягом якого розпадеться половина радіоактивних ядер, N 0/2.
Цей час визначається умовою t = Т і тому:
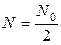
Тоді з формули (2) маємо:
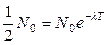
Звідки
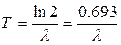 (3)
(3)
Значення періоду напіврозпаду для відомих в даний час радіоактивних ядер знаходиться в межах від 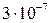 (с) до
(с) до 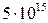 років.
років.
Число розпадів за одиницю часу (за 1 секунду) називається активністю А радіоактивного елементу:
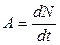
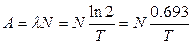 (4)
(4)
За одиницю активності прийнята активність одного грама радію, який зазнає за секунду 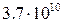 розпадів і називається кюрі (Кі)
розпадів і називається кюрі (Кі)
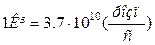
Ніякі зовнішні дії на речовину (великий тиск, температура, електричні і магнітні поля) не можуть впливати на характер і швидкість радіоактивного розпаду. На процес природньої радіоактивності можна впливати лише шляхом зміни стану ядер, наприклад, при опромінюванні ядер нейтронами.
Було виявлено, що радіоактивна речовина є джерелом трьох видів випромінювання:
Альфа-розпад (α) - є потік позитивно заряджених частинок (ядер гелію), що володіють строго визначеною енергією. α - частинки сильно поглинаються речовиною, оскільки вони володіють великою іонізуючою здатністю (в повітрі при нормальному тиску пробіг має величину близько декількох сантиметрів, в твердій речовині пробіг має величину порядку 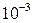 см, звичайний лист бумаги-повністю затримує α –частинки).
см, звичайний лист бумаги-повністю затримує α –частинки).
Бета-розпад (β). Існує три різновиди β-розпаду. В першому випадку ядро, що зазнає перетворення, випромінює електрон, в другому - позитрон, в третьому випадку, що називається електронним захопленням, ядро поглинає один з електронів К- оболонки, значно рідше L або М - оболонки. Частинки β-розпаду володіють різною енергією. Вони поглинаються речовиною значно слабкіше α-частинок.
γ –промені- це електромагнітні хвилі з довжиною хвилі 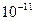 -
- 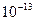 (м). γ - промені поглинаються речовиною значно слабкіше, ніж α і β-частинки. Проходячи через речовину γ- промені втрачають енергію, взаємодіючи з речовиною трьома способами:
(м). γ - промені поглинаються речовиною значно слабкіше, ніж α і β-частинки. Проходячи через речовину γ- промені втрачають енергію, взаємодіючи з речовиною трьома способами:
1) викликають фотоефект;
2) викликають Ефект Комптона;
3) утворюють пари позитрон-електрон
Випромінювання одного тільки γ - випромінення спостерігається дуже рідко, частіше воно супроводжує α і β-розпади.
Визначення періоду напіврозпаду довгоживучого ізотопу. У даній роботі визначається період напіврозпаду ізотопу калію, що розпадається, з масовим числом 40. Через високу хімічну активність металевого калію, він не придатний для подібних вимірювань. Тому користуються такою безпечною хімічною сполукою калія, як хлористий калій (КСl).
Якщо період напіврозпаду ізотопу дуже великий, то його активність під час вимірювання може вважатися постійною величиною.
З формули (4) виходить, що
 (5)
(5)
Це означає, що для визначення періоду напіврозпаду ізотопу, що повільно розпадається, необхідно знайти абсолютну активність А і число радіоактивних ядер препарату N.
Так як препарат в нашій установці не охоплюється лічильниками з усіх боків, то ми отримуємо при вимірюванні не абсолютну активність препарату, а відносну активність (швидкість рахунку N c). Але оскільки абсолютна активність A пропорційна швидкості рахунку N c то отримаємо:
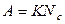 (6)
(6)
В умовах нашої установки коефіцієнт перерахунку К = 340,а для визначення Nc необхідно порахувати приладом кількість розпадів солі KCl за одиницю часу.
Для остаточного визначення періоду напіврозпаду Т за одиницю часу залишилося порахувати N (число радіоактивних ядер препарату). Скористаємося наступним:
1) по схемі розпаду ізотопу 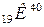 близько 89% його ядер шляхом електронного розпаду перетворюються на ядра протона кальцію
близько 89% його ядер шляхом електронного розпаду перетворюються на ядра протона кальцію 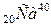 і близько 11% ядер шляхом електронного захоплення перетворюються на ядра ізотопу аргону
і близько 11% ядер шляхом електронного захоплення перетворюються на ядра ізотопу аргону 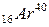 . Таким чином біля 89% загального числа розпадів
. Таким чином біля 89% загального числа розпадів 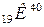 супроводжується випромінюванням β - частинки;
супроводжується випромінюванням β - частинки;
2) у природній суміші ізотопів калія знаходиться 0,0119% ядер радіоактивного, ізотопу 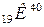 ;
;
3) також ще потрібно мати на увазі, що на 1 кг солі КСl доводиться 0,524 кг калію.
Звідси, знаючи масу m солі KCl, можна знайти масу m 1 радіоактивного ізотопу 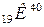 ,що бере участь в β-розпаді:
,що бере участь в β-розпаді:
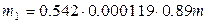 (7)
(7)
Тоді число радіоактивних атомів N в цій масі буде:
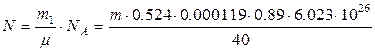
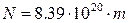 (8)
(8)
де 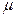 - атомна маса
- атомна маса 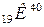 , N A - число Авогадро.
, N A - число Авогадро.
Дата публикования: 2015-09-17; Прочитано: 439 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
