 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электрохимия
|
|
Вопросы для самопроверки
1. Каковы возможные механизмы возникновения потенциалов на поверхности раздела фаз?
2. Что такое гальванический элемент? Какие скачки потенциалов имеются в гальваническом элементе? За счет каких процессов возникают эти скачки?
3. Схематически представьте медно-цинковый гальванический элемент. Какие процессы протекают на электродах при его работе?
4. Что такое диффузионный потенциал и почему он возникает? Какова его роль в гальваническом элементе?
5. Какими причинами может быть обусловлено возникновение скачка потенциала на границе раздела фаз? Обобщить на примерах возникновения скачков потенциалов в гальваническом элементе (в том числе и в мембранных электродах).
6. Определите электродвижущую силу медной концентрационной цепи при 18°С, если концентрации ионов меди в растворах равны 1 г-ион/л и 0,1 г-ион/л. Коэффициенты активности в растворах этих концентраций соответственно равны f  =0,05 и f
=0,05 и f 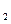 =0,16.
=0,16.
7. Перечислите мембранные электроды. Как возникает скачок потенциала на мембранном электроде? на биологической мембране?
8. Что такое окислительно-восстановительные потенциалы? Как и для чего определяют окислительно-восстановительные потенциалы почв?
Решение типовой задачи
Гальванический элемент состоит из медного и цинкового электродов. Приведите выражение для расчета ЭДС такого элемента с учетом концентраций ионов Cu 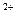 и Zn
и Zn 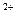 . Рассчитайте концентрацию ионов Cu
. Рассчитайте концентрацию ионов Cu 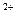 в гальваническом элементе, величина ЭДС которого равна 1,04 В, а концентрация ионов Zn
в гальваническом элементе, величина ЭДС которого равна 1,04 В, а концентрация ионов Zn 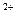 равна 0,1 моль/л (10
равна 0,1 моль/л (10 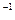 моль/л).
моль/л).
Решение. ЭДС элемента равна разности электродных потенциалов Е =  .
.
Схема записи элемента:
Cu 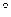 | Cu
| Cu 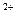 | | Zn
| | Zn 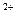 | Zn
| Zn
На электродах протекают процессы:
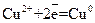

катод анод
Уравнения электродных потенциалов:
 ,
,  .
.
Итак, ЭДС = 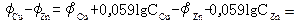
 .
.
Величины 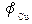 и
и 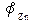 табличны, они равны соответственно +0,34 В и -0,76 В, так что
табличны, они равны соответственно +0,34 В и -0,76 В, так что
ЭДС = +0,34-(-0,76)+0,059  ,
,
ЭДС = 1,1 + 0,059  .
.
Выполнена первая часть задачи.
Найдем теперь значение  ; из уравнения для ЭДС имеем:
; из уравнения для ЭДС имеем:
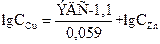
Подставим данные в задаче величины ЭДС и  .
.
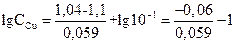 .
.
Так как 0,06  0,059, значит,
0,059, значит,  .
.
Следовательно,  моль/л=0,01 моль/л.
моль/л=0,01 моль/л.
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
102-105. Дайте вывод связи величины рН раствора водородного электрода с э.д.с. гальванического элемента каломельно-водородной цепи. Рассчитайте рН по данным таблицы.
Дата публикования: 2015-07-22; Прочитано: 523 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
