 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Растворы электролитов
|
|
Вопросы для самопроверки
1. Что называется ионным произведением воды? В каких пределах изменяется концентрация водородных и гидроксильных ионов в разбавленных водных растворах? Определить концентрацию ионов гидроксила, если концентрация ионов водорода равна 1,27.10 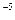 моль/л.
моль/л.
2. Изменится ли ионное произведение воды при повышении температуры? при приливании к раствору щелочи? кислоты?
3. Изменится ли и как рН раствора при повышении температуры? при приливании к раствору щелочи или кислоты?
4. Сравните величины степени диссоциации и константы диссоциации слабого электролита. Какая более полно описывает его способность к диссоциации?
5. Как находят степень и константу диссоциации криоскопическим методом?
6. Концентрация водородных ионов в водном растворе равна 5,3.10 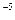 г-ион/л. Вычислите величину рН, концентрацию гидроксильных ионов и определите реакцию среды.
г-ион/л. Вычислите величину рН, концентрацию гидроксильных ионов и определите реакцию среды.
7. Используя понятие об активности, найти рН в 0,1 н растворе соляной кислоты; коэффициент активности равен 0,796.
8. Дайте определение кислот и оснований на основе теории электролитической диссоциации и на основе протолитической теории. Укажите на основе этих теории кислоты и основания в процессах:


9. Как рассчитывают величины рН в растворах гидролизованных солей по их концентрации?
10. Каковы типы буферных систем (по составу)?
11. Что такое буферная емкость?
12. Показать механизм буферного действия при добавлении небольших количеств: а) синильной кислоты, б) сильной щелочи к:
1) ацетатному буферу,
2) аммиачному буферу,
3) бикарбонатному буферу,
4) фосфатному буферу.
5) белковому буферу,
6) почвенному раствору.
Решение типовых задач
1. Раствор, содержащий 0,2394 г аммиака на 1000 г воды, замерзает при температуре -0,0142 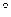 С. Вычислить степень диссоциации в этом растворе.
С. Вычислить степень диссоциации в этом растворе.
Решение. Степень электролитической диссоциации (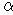 ) связана с изотоническим коэффициентом Вант-Гоффа (i) следующим уравнением
) связана с изотоническим коэффициентом Вант-Гоффа (i) следующим уравнением 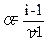 , где
, где  - число ионов, на
- число ионов, на
которое диссоциирует молекула электролита, по определению
 ,
,
 определяют по закону Рауля:
определяют по закону Рауля:
 ,
,
где m – моляльная концентрация раствора;
K – криоскопическая постоянная константа;
q – навеска растворенного вещества в граммах – по условию q = 0,2394 г;
W – количество растворителя в граммах – по условию W = 1000г;
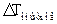 - разность температуры замерзания воды и температуры замерзания раствора – по условию,
- разность температуры замерзания воды и температуры замерзания раствора – по условию, 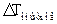 = 0
= 0  -(-0,0142
-(-0,0142 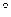 )=0,0142
)=0,0142 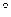 .
.
Тогда 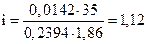 ,
,
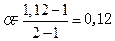 , или 12%.
, или 12%.
2. Вычислить рН 0,05 н раствора сильной одноосновной кислоты.
Решение. Так как кислота диссоциирована полностью и ее концентрация невелика, будем считать, что в этом растворе активная концентрация равна имеющейся концентрации. Отсюда [Н 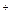 ] =0,05 моль/л, так как pH=-lg[Н
] =0,05 моль/л, так как pH=-lg[Н 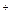 ], то
], то
pH=-lg5  10
10 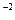 =-lg 5+2= -0,70+2= 1,3
=-lg 5+2= -0,70+2= 1,3
3. Вычислить рН в 0,1 н растворе уксусной кислоты.
Решение. Слабые кислоты диссоциируют обратимо:
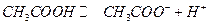
Равновесие характеризуется константой К= 1,85  10
10 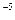 =
= 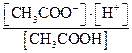 . Поскольку
. Поскольку 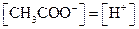 по уравнению реакции, а количество нераспавшихся на ионы молекул
по уравнению реакции, а количество нераспавшихся на ионы молекул 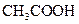 приблизительно равно исходному (диссоциация идет незначительно), то обозначив
приблизительно равно исходному (диссоциация идет незначительно), то обозначив 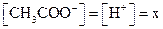 , будем иметь с учетом исходной 0,1 и концентрации:
, будем иметь с учетом исходной 0,1 и концентрации:
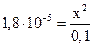
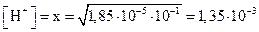 моль/л
моль/л
Отсюда pH = -lg 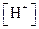 = -lg1,35
= -lg1,35  10
10 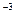 =3-lg1,35=2,87
=3-lg1,35=2,87
4. Вычислить рН буферного раствора, состоящего из 10 мл 0,1 М раствора 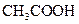 и 90 мл 0,1 М раствора
и 90 мл 0,1 М раствора 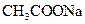 .
.
Константа электролитической диссоциации уксусной кислоты равна 1,85  10
10 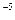 .
.
Решение. По уравнению буферной смеси концентрация водородных ионов в буферном растворе 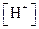 =
= 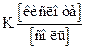 или в других обозначениях
или в других обозначениях 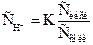 .
.
где 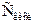 - концентрация кислоты,
- концентрация кислоты,
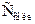 - концентрация соли в приготовленной буферной смеси.
- концентрация соли в приготовленной буферной смеси.
Концентрация кислоты и соли в смеси может быть рассчитана по данным задачи:

 моль/л,
моль/л,
где 10 и 90 – объемы кислот и соли, взятые для приготовления буферного раствора, мл;
10+90 – общий объем раствора.
Полученные величины подставляются в уравнение буферной смеси:
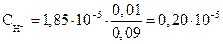 моль/л
моль/л
Далее находим величину рН:
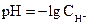 ,
,
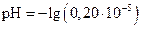 ,
,
рН= -(lg0,20-51g10) = -(1,30-5) = -(-0,70-5) =5,70;
рН=5,70.
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
81-90. Сделайте расчеты величин рН по данным в таблицеконцентрациям или величин концентраций вещества по данным в таблице величинам рН. Расчеты сделайте для всех столбцов таблицы, относящихся к вашему варианту. Коэффициент активности в растворах сильных электролитов = 1.
| № задачи | Вещество | С, моль/л | 
| 
| pH | pOH |
| HCl NaOH | 10 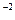
| 10,5 | ||||
| HCl NaOH | 2,7 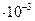
| |||||
CH 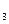 COOH
KOH COOH
KOH
| 5 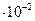
|
10 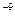
| ||||
HNO 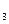 NH
NH  OH OH
| 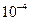
| 10 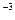
| ||||
| NaOH HCl | 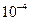
| 4,89 | ||||
CH 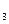 COOH
KOH COOH
KOH
| 4,8 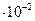
|
10 
| ||||
| HCl NaOH | 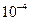
| 4,5 | ||||
HNO 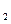 KOH
KOH
| 1,5 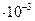
|
10 
| ||||
CH 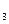 COOH
NaOH COOH
NaOH
| 9,5 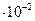
| |||||
NH  OH
HCl OH
HCl
| 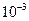
|
10 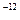
|
91-92. Почему буферные растворы препятствуют изменению рН раствора? Рассчитайте рН по данным таблицы (концентрации кислоты и соли одинаковы).
| № задачи | Буферная смесь | Количество кислоты, мл | Количество соли, мл |
CH 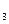 COOH
CH COOH
CH 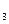 COONa COONa
| |||
NaH 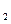 PO PO  Na
Na 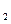 HPO HPO 
|
93-95. Каково биологическое значение буферных смесей? Приведите примеры буферных растворов, встречающихся в живых организмах. Рассчитайте соотношение кислоты и соли (концентрации равные) в буферной смеси с величинами рН, представленными в таблице.*
| № задачи | Буферная смесь | рН буферной смеси |
KH 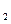 PO PO  Na
Na 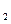 HPO HPO 
| 6,81 | |
CH 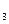 COOH
CH COOH
CH 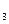 COONa COONa
| 4,75 | |
H 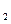 CO CO 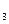 NaHCO
NaHCO 
| 7,3 |
(*Константы диссоциации даны в приложении).
Дата публикования: 2015-07-22; Прочитано: 803 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
