 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическая кинетика и катализ
|
|
Варианты контрольных заданий
| Варианты | Номера задач | |||||||||
| 00,50 | ||||||||||
| 01,51 | ||||||||||
| 02,52 | ||||||||||
| 03,53 | ||||||||||
| 04,54 | ||||||||||
| 05,55 |
Продолжение
| 06,56 | ||||||||||
| 07,57 | 167 | |||||||||
| 08,58 | ||||||||||
| 09,59 | ||||||||||
| 10,60 | ||||||||||
| 11,61 | ||||||||||
| 12,62 | ||||||||||
| 13,63 | ||||||||||
| 14,64 | ||||||||||
| 15,65 | ||||||||||
| 16,66 | ||||||||||
| 17,67 | ||||||||||
| 18,68 | ||||||||||
| 19,69 | ||||||||||
| 20,70 | ||||||||||
| 21,71 | 18! | |||||||||
| 22,72 | ||||||||||
| 23,73 | ||||||||||
| 24,74 | ||||||||||
| 25,75 | ||||||||||
| 26,76 | ||||||||||
| 27,77 | ||||||||||
| 28,78 | ||||||||||
| 29,79 | ||||||||||
| 30,80 | ПО | |||||||||
| 31,81 | ||||||||||
| 32,82 | ||||||||||
| 33,83 | ||||||||||
| 34,84 | 15S | |||||||||
| 35,85 | ||||||||||
| 36,86 | ||||||||||
| 37,87 | ||||||||||
| 38,88 | ||||||||||
| 39,89 |
Окончание
| 40,90 | ||||||||||
| 41,91 | ||||||||||
| 42,92 | ||||||||||
| 43,93 | ||||||||||
| 44,94 | ||||||||||
| 45,95 | ||||||||||
| 46,96 | ||||||||||
| 47,97 | ||||||||||
| 48,98 | ||||||||||
| 49,99 |
ФИЗИЧЕСКАЯ ХИМИЯ
1. Агрегатное состояние вещества
Агрегатное состояние — важнейшая характеристика вещества. Обычно указывают агрегатное состояние при комнатной температуре, хотя большинство веществ при соответствующих изменениях температуры могут находиться в любом из агрегатных состояний. Важнейшие из параметров, определяющих агрегатное состояние — межмолекулярное взаимодействие и размеры молекул. Чем больше эти величины, тем вероятнее, что вещество будет твердым при комнатной температуре.
Изучая конкретно каждое из агрегатных состояний (газообразное, жидкое, твердое), сравните их между собой по расстоянию между молекулами, возможным способам перемещения молекул и силам межмолекулярного взаимодействия. Также проведите сопоставление понятий «реальный газ» и «идеальный газ», сравнив уравнение Ван-дер-Ваальса  и уравнение Менделеева-Клапейрона
и уравнение Менделеева-Клапейрона  , сделав упор на физическом смысле констант уравнений Ван-дер-Ваальса; здесь Р — давление, V — объем, Т — температура (по Кельвину) газа, а и b — константы. При изучении твердого состояния обратите внимание на различие между кристаллическими и стеклообразными телами, сравните последние с жидкостями. Изучая жидкое состояние, постарайтесь уяснить физический смысл понятий поверхностное натяжение и вязкость.
, сделав упор на физическом смысле констант уравнений Ван-дер-Ваальса; здесь Р — давление, V — объем, Т — температура (по Кельвину) газа, а и b — константы. При изучении твердого состояния обратите внимание на различие между кристаллическими и стеклообразными телами, сравните последние с жидкостями. Изучая жидкое состояние, постарайтесь уяснить физический смысл понятий поверхностное натяжение и вязкость.
Изучая молекулярно-кинетическую теорию газов, обратите внимание на ее важнейший вывод, связывающий параметры уравнения состояния со средней кинетической энергией движущихся молекул. В соответствии с выводами этой теории,  ; здесь М — масса моля газа;
; здесь М — масса моля газа; 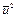 — среднее значение квадрата скорости.
— среднее значение квадрата скорости.
Решение типовой задачи
1. Рассчитать скорость движения молекул водорода при температуре 25°С.
Решение. Основным выводом молекулярно-кинетической теории газов является установление связи между величинами PV = RT и средней кинетической энергией молекул газа 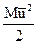 , эта связь выражается формулой:
, эта связь выражается формулой:
PV=RT=2/3 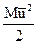 или RT=
или RT= 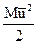
где R — универсальная газовая постоянная;
Т — температура газа, °К;
М — молярная масса газа (масса моля), кг;
 средняя скорость движения молекул.
средняя скорость движения молекул.
Таким образом, 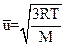
Рассчитываем значение  для молекулы водорода: по условию М =
для молекулы водорода: по условию М =  кг; Т = 25 + 273 = 298 (К);
кг; Т = 25 + 273 = 298 (К);
R = 8,31 дж/моль К,
тогда  м/с.
м/с.
Вопросы для самопроверки
1. Назовите переходы из одного агрегатного состояния в другое.
2. Опишите явления, сопровождающие эти переходы-
3. Схематично на графике представьте изменение температуры во времени при нагревании некоторого количества вещества в области температур, где имеется плавление и кипение вещества.
4. Что такое плазма? Каковы особенности ее физических свойств?
5. Что такое уравнение состояния? Каким уравнением описывается состояние идеального газа?
6. Какие физические законы объединены в уравнении Менделеева-Клапейрона?
7. Чем отличаются реальные газы от идеальных газов? Какими уравнениями состояния описываются реальные газы?
8. Какой физический смысл имеет газовая постоянная? Каковы ее возможные размерности?
9. В чем сущность молекулярно-кинетической теории газов?
10.Что такое средняя квадратичная скорость движения молекул? Как она связана с температурой?
11.Как различается средняя скорость движения молекул различных газов при повышении молекулярной массы, если эти газы находятся при одной температуре?
12.Что такое длина свободного пробега молекулы? Какое она имеет значение для расчета скоростей химических реакций?
13.Поясните смысл таких характеристик жидкости как поверхностное натяжение, вязкость, давление насыщенного пара. От каких собственных характеристик вещества они зависят?
14.Как измеряют поверхностное натяжение и вязкость?
15.Перечислите известные вам типы кристаллических решеток.
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
1-10. Кратко укажите, в чем различие и сходство между газообразным, жидким и твердым состоянием? Какие из собственных характеристик вещества определяют его агрегатное состояние при обычных условиях? Почему некоторые вещества не имеют всех трех агрегатных состояний? Приведите примеры. Используя для расчетов уравнение Менделеева - Клапейрона и закон Авогадро, проставьте в таблице недостающие данные в соответствии со своим вариантом (в двух рядах таблицы!)
11-20. Как связано произведение РV (RТ) с суммарной кинетической энергией молекул 1 моля газа? Какой физический смысл вкладывает молекулярно-кинетическая теория в понятие «температура» и «абсолютный нуль» (-273  С)? Используя выводы молекулярно-кинетической теории, рассчитайте недостающие в таблице данные (в соответствии со своим вариантом).
С)? Используя выводы молекулярно-кинетической теории, рассчитайте недостающие в таблице данные (в соответствии со своим вариантом).
| №задачи | Формула газа | Давление, атм | Давление, Па | Число молей | Объём, л | Масса, кг | Число молекул | 
| 
|
| 1,2 | 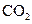
| 0.040 | |||||||
| 1,2,3 | 
| 
| 0.5 | ||||||
| 3,4 | 
| 
| |||||||
| 4,5 | 
| 0.5 | |||||||
| 5,6 | 
| 2.5 | |||||||
| 6,7 | 
| I.2 | |||||||
| 7,8 | 
| 
| 0.35 | ||||||
| 8,9 | 
| ||||||||
| 9,10 | 
| 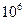
| 0.75 | ||||||

|
| № задачи | Формула вещества | Молек. Масса, кг | 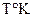
| 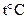
| Скорость движ. молекул, м/с |
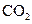
| |||||

| 609,47 | ||||

| |||||
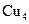
| 500,1 | ||||
| 0,032 | |||||

| |||||

| |||||

| |||||

| |||||

| -20 |
2. Химическая термодинамика и термохимия
Вопросы для самопроверки
1. Что такое энергия? Перечислите известные вам ее виды. Сформулируйте закон сохранения энергии.
2. Что понимается под внутренней энергией термодинамической системы? Что такое энтальпия? Какова связь между внутренней энергией и энтальпией?
3. Сформулируйте первое начало термодинамики. Приведите его математическое выражение. В чем особенности тепловой энергии?
4. Сформулируйте закон Гесса. Укажите условия его применения. Как рассчитывают тепловые эффекты реакций, которые не могут быть найдены экспериментально? Какие данные для этого необходимы?
5. Укажите связь закона Гесса с первым законом термодинамики.
6. Как определяют теплоты реакций из энтальпий образования веществ?
7. Что такое параметр состояния? Какие параметры состояния термодинамической системы являются интенсивными, экстенсивными? Перечислите термодинамические параметры, применяющиеся для описания систем, в которых протекает химическая реакция (в том числе и биологических).
8. Какие процессы в термодинамике называются обратимыми; необратимыми? Приведите примеры. Как изменяется энтропия систем, в которых протекают эти процессы?
9. Что такое энтропия? Какой физический смысл имеет различие величин  S и
S и  Q/T в случае необратимых процессов? Как может изменяться энтропия изолированной, закрытой и открытой систем?
Q/T в случае необратимых процессов? Как может изменяться энтропия изолированной, закрытой и открытой систем?
10. Каково статистическое толкование понятия энтропия? Как изменяется энтропия в процессе жизнедеятельности и гибели живого организма как открытой системы?
11. Укажите, увеличится или уменьшится энтропия в следующих процессах: плавление льда, разложение N204 (N204 = 2N02), получение аммиака (N2 + 3H2 = 2NH3), растворение поваренной соли в воде. Дайте объяснения на основе представлений об изменении степени упорядоченности в этих системах.
12. Сформулируйте третий закон термодинамики. Как на его основе производят вычисление абсолютных энтропий? Для чего нужны эти величины?
13. Как связана величина свободной энергии химического процесса с константой его равновесия? Каково значение этого выражения?
14. Рассмотрите, как изменяется энтропия при переходе от неживой (косной) материи к живому веществу в процессе эволюции.
15. Согласуется ли возникновение высокоорганизованной материи-жизни со вторым законом термодинамики?
Решение типовой задачи
Вычислить изменение стандартной энтропии образования 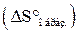 этанола из элементов, пользуясь табличными данными абсолютных энтропий веществ при 25
этанола из элементов, пользуясь табличными данными абсолютных энтропий веществ при 25 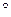 С (стандартных энтропий веществ)
С (стандартных энтропий веществ) 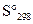 .
.
Вещество 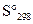 Дж/к
Дж/к  моль
моль
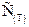 графит 5,21
графит 5,21
 (г) 130,52
(г) 130,52
 (г) 205,18
(г) 205,18
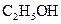 (г) 160,78
(г) 160,78
Решение.

Уравнение образования этанола из элементов:
2С+3  +
+ 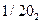

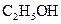
Подставляя величины 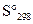 в уравнение для данной реакции, получим с учетом коэффициентов уравнения реакции:
в уравнение для данной реакции, получим с учетом коэффициентов уравнения реакции:
 = 160,78-(2*5,21+3*130,52+ ½*205,18) =
= 160,78-(2*5,21+3*130,52+ ½*205,18) =
=-343,79 Дж/к* моль
2. Вычислите изменение энтропии при плавлении 10 г воды. Удельная теплота плавления q равна 19,12 Дж/г.
Решение. Изменение энтропии для изотермического обратимого процесса можно рассчитать по формуле:

где  - изменение энтропии процесса;
- изменение энтропии процесса;
Q – теплота процесса;
T – температура  К
К
Температура плавления льда 273, 16°К.
Таким образом, 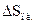 1 г воды найдем как
1 г воды найдем как 
Для плавления 10 г вещества будем иметь 0,70 Дж/К  г.
г.
3. Найти энтальпию процесса, соответствующего простейшему уравнению фотосинтеза, по величинам энтальпий образования исходных веществ и продуктов реакции.
Решение. Простейшее уравнение фотосинтеза:

Стандартные энтальпии образования веществ, участвующих
в этом процессе найдем в таблице (см. приложения).
 = -2820,1 кДж/моль
= -2820,1 кДж/моль
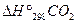 = -393,5 кДж/моль
= -393,5 кДж/моль
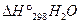 = -241,8 кДж/моль
= -241,8 кДж/моль
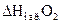 , как простого вещества, равно 0.
, как простого вещества, равно 0.
Воспользуемся для решения задачи законом Гесса. Для этого
запишем термохимические уравнения всех процессов образования указанных веществ.
 (1)
(1)
 (2)
(2)
 (3)
(3)
Умножим уравнения (2) и (3) на минус шесть и сложим почленно все эти уравнения, получим:

Произведем алгебраическое сложение:

переносим вправо переносим влево
окончательно:

Получим искомое уравнение фотосинтеза, из которого
ясно, что

Итак, 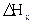 = -2820,1-6 *(-393,5)-6 (-241,8) =991,7 кДж/моль
= -2820,1-6 *(-393,5)-6 (-241,8) =991,7 кДж/моль
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
21-30. Сформулируйте закон Гесса. В каких условиях теплота реакции может быть заменена изменением энтальпии процесса? Найдите энтальпию реакции по величинам энтальпий образования исходных веществ и конечных продуктов (в соответствий со своим вариантом).
| № задачи | Процесс |
2С  Н Н  +5O +5O  =4CO =4CO  +2H +2H  O O
| |
CH  +2O +2O  =CO =CO  +2H +2H  O O
| |
2CH  OH+3O OH+3O  =2CO =2CO  +4H +4H  O O
| |
CH  COOH+2O COOH+2O  =2CO+2H =2CO+2H  O O
| |
CaO+H  O=Ca(OH) O=Ca(OH) 
| |
2CO+4H  =C =C  H H 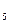 OH+H OH+H  O O
| |
Al  O O  +3SO +3SO  =Al =Al  (SO (SO  ) ) 
| |
4NH  +5O +5O  =4NO+6H =4NO+6H  O O
| |
Fe  O O  +2Al=2Fe+Al +2Al=2Fe+Al  O O 
| |
Fe  O O  +3CO=2Fe+3CO +3CO=2Fe+3CO 
|
ЗАДАЧИ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ
31-40. Какая термодинамическая функция называется энтропией? Каково её статистическое толкование? Как вычисляется изменение энтропии в равновесном изотермическом процессе? Найдите изменение энтропии в указанных ниже процессах при стандартных условиях.
| № задачи | Процессы |
| 31,32 | N  +3H +3H  =2NH =2NH 
|
| 33,34 | H  +J +J  =2HJ =2HJ
|
| 35,36 | 2NO+O  =2NO =2NO 
|
| 37,38 | H  +Cl +Cl  =2HCl =2HCl
|
| 39,40 | кипение 1 кмоля воды 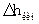 (уд.)=2,257 кДж/г (уд.)=2,257 кДж/г
|
Химическая кинетика и катализ
Вопросы для самопроверки
1. Что понимается под скоростью химической реакции? Какие факторы влияют на скорость реакции? Как изменяется скорость реакции во времени?
2. Какая реакция является реакцией первого порядка? Каким уравнением она описывается?
3. Что такое период полураспада?
4. Какие реакции называются реакциями второго порядка? Каким уравнением они описываются?
5. Каков физический смысл константы скорости? От каких факторов она зависит?
6. Как влияет температура на скорость реакции? Сформулируйте правило Вант-Гоффа.
7. Почему при повышении температуры скорость реакций возрастает? Что такое энергия активации? Как и для чего ее определяют?
8. В чем сущность теории Аррениуса, описывающей влияние температуры на скорость реакций?
9. Что такое катализ? Катализатор? Почему катализаторы не влияют на смещение равновесия? Приведите примеры гомогенного катализа.
10. Как различные теории объясняют каталитическое действие? В чем особенности гетерогенного катализа?
11. опишите основные особенности ферментативного катализа. Приведите примеры процессов, протекающих под действием ферментов. Сравните активность ферментов как катализаторов с активностью искусственно полученных каталитических систем.
12. Какие вещества называются ингибиторами и ретардантами? Где они применяются?
13. Приведите примеры веществ, являющихся ингибиторами нитрификации, ингибиторами окислительно-восстановительных процессов, протекающих при хранении продуктов.
Решения типовых задач
1. Период полураспада ( ) полония равен 137 дням. Найти время, в течение которого от исходного количества вещества - 0,1 г - останется 0,01 г (10%).
) полония равен 137 дням. Найти время, в течение которого от исходного количества вещества - 0,1 г - останется 0,01 г (10%).
Решение. Радиоактивный распад описывается кинетическим уравнением реакции первого порядка, т. е.  , или kt=ln
, или kt=ln 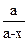 , или kt=2,3 1g[a/(a-x)], где к - константа скорости, t - время реакции, а - начальная концентрация или количество вещества, х - текущая концентрация, прореагировавшее количество, (а-х) - конечная концентрация. Кроме того, константа скорости связана с периодом полураспада соотношением к=0,69/
, или kt=2,3 1g[a/(a-x)], где к - константа скорости, t - время реакции, а - начальная концентрация или количество вещества, х - текущая концентрация, прореагировавшее количество, (а-х) - конечная концентрация. Кроме того, константа скорости связана с периодом полураспада соотношением к=0,69/  . Отсюда
. Отсюда 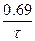
 t=2.3 lg
t=2.3 lg 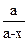 .
.
Подставим данные задачи в полученное уравнение:
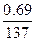
 t=2,3
t=2,3  lg
lg 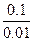
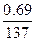
 t=2,3
t=2,3  lg10=2,3
lg10=2,3  I
I
t= 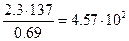 дней
дней
2. Определить энергию активации реакции разложения йодистого водорода, если известны константы скоростей при двух температурах: 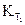 , =8,1
, =8,1  10
10 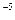 при T
при T 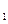 =629°K и
=629°K и  = 1,06
= 1,06  10
10  при Т
при Т  =781° К.
=781° К.
Решение. Зависимость константы скорости от энергии активации определяется уравнением:
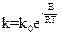 или
или  ,где к - константа скорости при данной температуре Т,
,где к - константа скорости при данной температуре Т, 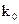 -константа, R-газовая постоянная, е - основание натуральных логарифмов, Е - энергия
-константа, R-газовая постоянная, е - основание натуральных логарифмов, Е - энергия
активизации.
Используя данные задачи, имеем два уравнения:
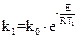
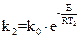
Или в логарифмической форме:
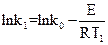 (1);
(1); 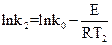 (2)
(2)
Вычтем из уравнения (1) уравнение (2):

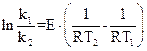 ,
,
отсюда 2,3 lg 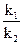 =E
=E 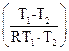 , E=2,3 lg
, E=2,3 lg 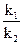 :
: 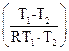
Подставим данные задачи и R=8,313 Дж/к моль.
E= 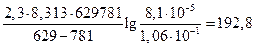 кДж/моль.
кДж/моль.
Задачи для контрольной работы
41-50. Что понимается под скоростью реакций? Какие факторы влияют на скорость реакции? Какая реакция называется реакцией первого порядка? Каким кинетическим уравнением она описывается? Найти количество вещества, оставшееся после протекания реакции, или время реакции по данным таблицы.
| № задания | Процесс | Порядок реакции | Период полураспада | Время протекания реакции, с | Начальная концентрация (кол-во) | Конечная концентрация (кол-во) | Константа скорости |
распад изотопа 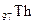
| первый | 44с | 1 г | ||||
| 
| 0,001 моль/л | 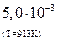
| ||||
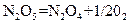
| 
| 0,1 г | 
| ||||
| распад изотопа | 
| 10 дн. | 10 г | 0,1 г | |||

| 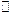
| 10 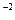 моль/л
моль/л
| 3,44 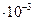
| ||||
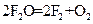
| 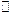
| 10  моль/л
моль/л
| 1,04 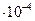
| ||||
| распад изотопа | 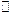
| 100дн. | 100 г | 0,1 г | |||

| второй | 0,16 | 0,007 | ||||
| распад изотопа | первый | 300дн. | 100 г | 100 г | |||
| - | второй | 100% | 90% | 4 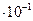
|
51-54. Как зависит скорость реакции от температуры? В чем сущность теории Аррениуса, описывающей влияние температуры на скорость реакции? Что такое энергия активации? Вычислите энергию активации процесса по данным таблицы.
Дата публикования: 2015-07-22; Прочитано: 1472 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
