 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Механизм гидролиза по аниону
|
|
1. Анионы, обладающие высоким поляризующим действием: сульфид, карбонат, ацетат, сульфит, фосфат, цианид, силикат – анионы слабых кислот. У них вакантной орбитали нет, работает избыточный отицательный заряд.

Анион, обладающий хорошо выраженной донорной способностью. Донор вызывает поляризацию гидратной оболочки. Результат поляризации – изменение рН > 7 (щелочная)
2. Анионы, не способные поляризовать гидртную оболочку (водородная связь не превращается в ковалентную, отрыва иона Н+ не наблюдается). Это слабые доноры электронной пары, поэтому взаимодействия между молекулами воды и анионом не будет. Это анионы сильных кислот: хлорид, бромид, сульфат, нитрат, перхлорат. рН вменятся не будет.
Количественной характеристикой гидролиза является степень гидролиза и константа гидролиза.
1. Гидролиз обратим, существует равновесие. Для любой равновесной системы справедлив ЗДМ, по которому можно определить Кр.
Произведение Кр и концентрации воды – есть Кгидролиза.
2. Степень гидролиза (h) – отношение количества соли, подвергшиеся гидролизу, к общему количеству растворенной соли. Она изменяется, не табличная величина.
 (81)
(81)
Связь между константой гидролиза и степенью гидролиза выражаются соотношением:
 (82)
(82)
Из формулы видно, что степень гидролиза увеличивается при разбавлении раствора, она также увеличивается при повышении температуры.
Примеры гидролиза:
1. Кат и Ан не поляризуют гидратную оболочку (Соль сильной кислоты и сильной щелочи).
NaCl + HOH = NaOH + HCl
Na+ + Cl- + HOH = Na+ + OH- + H+ + Cl-
HOH = OH- + H+ (смещение равновесия ←)
Вывод: гидролиз не протекает, рН не меняется (рН=7).
2. Кат не поляризует гидратную оболочку, а Ан обладает поляризующим действием (Соль слабой кислоты и сильной щелочи).
CH3COONa + HOH = CH3COOH + NaOH
CH3COO- + HOH + Na+ = CH3COOH + OH- + Na+
CH3COO- + HOH = CH3COOH + OH-



Тогда:  (83)
(83)
 (84)
(84)
Гидролиз многозарядных ионов протекает ступенчато
CO32- + HOH ↔ HCO3- + OH- 1-я ступень
HCO3- + HOH ↔ CO2∙H2O + OH- 2-я ступень практически не протекает.
В выражение константы гидролиза подставляется константа ионизации той стадии, на которой получен гидролизующийся ион.
Чем меньше константа ионизации, тем больше константа гидролиза. Чем слабее образующееся кислота, тем полнее протекает гидролиз.
Вывод: протекает обратимый гидролиз (по аниону), рН меняется, рН>7 (щелочная).
3. Ан не поляризует гидратную оболочку, а Кат обладает поляризующим действием (Соль сильной кислоты и слабого основания).
AlСl3 + HOH ↔ AlOHCl2 + HCl 1-я ступень гидролиза
Al3+ + HOH + 3Cl- = AlOH2+ + 2Cl- + H+ + Cl-
Al3+ + HOH = AlOH2+ + H+
2-я и 3-я ступень практически не протекают вследствие обратимости процесса.
 (85)
(85)
 (86)
(86)
Вывод: протекает обратимый гидролиз (по катиону), рН меняется, рН<7 (кислая).
4. Ан и Кат поляризуют гидратную оболочку (обладают поляризующим действием) (Соль слабой кислоты и слабого основания).
Al2(CO3)3 + 6HOH → 2Al(OH)3↓ + 3H2CO3
2Al3+ + 3CO32- + 6HOH → 2Al(OH)3↓ + 3CO2↑ + 3HOH
 (87)
(87)
 (88)
(88)
Вывод: гидролиз необратим, протекает ступенчато, полностью. рН ≈ 7.
При одновременном гидролизе катиона и аниона рН определяется более сильным электролитом – с большей Кд и меньшим рК:
CH3COONH4 + HOH → NH3·H2O + CH3COOH
Kb=1,8·10-5 Кa=1,86·10-5 => рН ≈ 7
(NH4)2S + HOH → NH3·H2O + H2S
Kb=1,8·10-5 Кa =5, 6·10-12 => рН > 7
Факторы, влияющие на смещение химического равновесия процесса гидролиза (согласно принципу Ле-Шателье):
1. Так как гидролиз процесс эндотермический (ΔΗ>0), то повышение температуры увеличивает процесс гидролиза (равновесие смещается вправо).
2. Разбавление раствора водой способствует протеканию процесса, связанного с его поглощением, т.е. усилению гидролиза.
3. Введение разноименных ионов также усиливает гидролиз.
К2СО3 + Н2О = 2КОН + Н2СО3
2К+ + СО32- + Н2О = 2К+ + 2ОН- + Н2СО3
СО32- + Н2О = 2ОН- + Н2СО3, введение Н+ связывает ОН- в воду и тем самым смещает равновесие вправо.
4. При добавлении кислоты к раствору соли кислой среды или добавлении щелочи к раствору соли щелочной среды гидролиз подавляется за счет увеличения концентрации одного из продуктов реакции (равновесие смещается влево – введение одноименных ионов)
К2СО3 + Н2О = 2КОН + Н2СО3
2К+ + СО32- + Н2О = 2К+ + 2ОН- + Н2СО3
СО32- + Н2О = 2ОН- + Н2СО3, введение ОН- смещает равновесие влево.
Рассматривая поведение кислых и основных солей в растворе, следует учитывать как процессы ионизации, так и процессы гидролиза. Например, NaH2PO4 и PbOHCl подвергаются: а) первичной ионизации ионизации, которая протекает практически полностью:
NaH2PO4 ↔ Na+ + H2PO4-
PbOHCl ↔ PbOH+ + Cl-
б) вторичной ионизации сложных ионов:
H2PO4- ↔ Н+ + НРО42-
PbOH+ ↔ Pb2+ + OH-
в) и гидролизу сложных ионов:
H2PO4- + НОН ↔ Н3РО4 + ОН-
PbOH+ + HOH ↔ Pb(OH)2 + H+
Процессы а) определяют исходную концентрацию сложных ионов в растворе; последняя будет, очевидно, равна концентрации соли, поскольку соли – сильные электролиты. Процессы б) и в) определяют равновесную концентрацию простых и сложных ионов в растворе, а также концентрацию Н+ и ОН-.
Чтобы определить, какую реакцию исеет раствор кислой соли, например, NaH2PO4, кислую или щелочную, следует определить, какой процесс протекает в большей степени: ионизация (б) или гидролиз (в). Для этого надо сравнить константу ионизации H2PO4- с константой гидролиза этого иона:
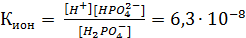

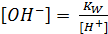 , где КW – ионное произведение воды.
, где КW – ионное произведение воды.
 = 1,33·10-12
= 1,33·10-12
 - константа ионизации Н3РО4 по I ступени. Равна 7,3·10-3 (прилож. 7).
- константа ионизации Н3РО4 по I ступени. Равна 7,3·10-3 (прилож. 7).
Кион > КГ, в растворе будет преодладать процесс ионизации, поэтому рН < 7 (среда кислая).
В расчетах необходимо придерживаться правилом: в константу гидролиза подставляется ионизации той стадии, на которой появился данный ион, подвергающийся гидролизу.
Н3РО4 ↔ Н2РО4- + Н+ (I стадия).
Контрольные вопросы и задания
1. Что называется ионным произведением воды? Чему оно равно?
2. Что такое рН раствора? Какой раствор называется нейтральным, щелочным, кислым?
3. Определите рН, если [H+] = 2·10-5 моль/дм3.
4. Определите [H+] в растворе, если рН = 5,4.
5. Что такое буферный раствор, буферная емкость? Значение буферных растворов в медицине и фармации.
6. Что называется гидролизом? Механизм гидролиза. Гидролиз аквакатионов. Гидролиз анионов. Совместный гидролиз (катиона и аниона).
7. Катионы и анионы как сопряженные кислота и основание.
8. Как можно провести гидролиз до конца и наоборот, замедлить процесс гидролиза? Какой принцип из ранее изученных тем следует здесь применить?
9. Степень и константа гидролиза (определение, расчет).
10. Значение гидролиза и применение его в медицине и фармации.
Дата публикования: 2014-11-18; Прочитано: 1965 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
