 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1.Вычислите растворимость соли PbI2, если ПР = 8 · 10-9
|
|
Пример 1. Вычислите растворимость соли PbI2, если ПР = 8 · 10-9.
Решение. Растворимость (S) – способность вещества растворяться. Поэтому растворимость определяется концентрацией вещества в растворе:
PbI2 ↔ Pb2+ + 2I-; ПР = [Pb2+]·[I-]2. Тогда ПР = S·(2S)2 = 4S3
S S 2S
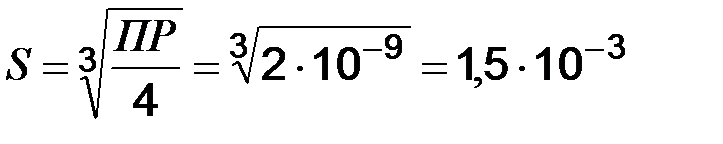 моль/дм3.
моль/дм3.
Пример 2. Вычислите ПР AgCl, если его растворимость в воде при 25 0С составляет 0,0018 г/л.
Решение. ПР – это произведение концентраций ионов, а концентрация измеряется в моль/л, то переводим растворимость в моль/л: S =  = 1,25 · 10-5 моль/л.
= 1,25 · 10-5 моль/л.
AgCl ↔ Ag+ + Cl- ПР = [Ag+]·[Cl-] = S2 = (1,25 ·10-5)2 = 1,56 · 10-10.
Пример 3. Выпадет ли осадок, если слить равные объемы 0,02 М растворов AgNO3 и KI?
Решение. AgNO3 + KI → AgI (↓) + KNO3; ПР(AgI) = 8,5 · 10-17 (табл. величина). Осадок выпадает когда [Ag+]·[I-] > ПР.
Так как слили равные объемы растворов, то концентрации каждого раствора в полученном растворе уменьшились в 2 раза: [Ag+] =[I-] = 0,01 моль/л. [Ag+]·[I-] = (0,01)2 = 10-4
Тогда 1 · 10-4 > 8,5 · 10-17. Следовательно, осадок выпадает.
Пример 4. Выпадет ли осадок, если слить 0,6 дм3 0,01 М раствора MgSO4 и 0,4 дм3 0,002 М раствора Na2CO3? ПР(MgCO3) = 1 · 10-5.
Решение. MgSO4 + Na2CO3 → MgCO3(↓) + Na2SO4
Условие выпадения осадка: [Mg2+]·[CO32-] > ПР(MgCO3)
Объем полученного раствора – 1 дм3
Объем MgSO4 увеличился в 1/0,6 = 1,6 раза, следовательно, [Mg2+] в столько же раз уменьшилось: [Mg2+] = 0,01/1,6 = 6·10-3 моль/дм3.
Объем Na2CO3 увеличился в 1/0,4 = 2,5 раза, следовательно, [CO32-] в столько же раз уменьшилось: [CO32-] = 0,002/2,5 = 8·10-4 моль/дм3.
[Mg2+]·[CO32-] = 6·10-3 · 8·10-4 = 4,8 · 10-6
Тогда 4,8 · 10-6 < 1 · 10-5. Следовательно, осадок не выпадает.
Пример 5. Во сколько раз уменьшится растворимость AgI в 0,001 М KI по сравнению с его растворимостью в воде? ПР(AgI) = 8,5 · 10-17.
Решение. Находим растворимость AgI в воде: AgI ↔ Ag+ + I-; ПР = S2
S =  моль/л.
моль/л.
Находим растворимость AgI в 0,001 М КI: ПР = [Ag+]·[I-] = Х· 0,001;
Х = 8,5 · 10-17 / 0,001 = 8,5 · 10-14 моль/л.
Находим во сколько раз уменьшилась растворимость в растворе с одноименными ионами по отношению к воде:  раз.
раз.
Дата публикования: 2014-11-18; Прочитано: 4924 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
