 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Примеры решения задач. Пример 1.Определите массовую долю полученного раствора, если 18 дм3 48% раствора серной кислоты (ρ=1,38 г/см3) смешали с 2 дм3 20% раствора серной
|
|
Пример 1. Определите массовую долю полученного раствора, если 18 дм3 48% раствора серной кислоты (ρ=1,38 г/см3) смешали с 2 дм3 20% раствора серной кислоты (ρ=1,143 г/см3).
Решение. Задачу решаем по формуле (14):
18000 см3·1,38 г/см3·48% + 2000 см3·1,143 г/см3·20% = (18000 см3·1,38 г/см3 + 2000 см3·1,143 г/см3)·Х
24840 г·48% + 2286 г·20% = (24840 г + 2286 г) ·Х
1192320 + 45720 = 27126 ·Х
Х = 45,6% - массовая доля полученного раствора.
Пример 2. Найдите молярную, нормальную и моляльную концентрацию раствора серной кислоты с массовой долей 15% (ρ = 1,10 г/см3).
Решение. Для расчета данных концентраций воспользуемся формулами перерасчета одной концентрации в другую:



Пример 3. Приготовьте 100 см3 раствора гидроксида калия с массовой долей 5% (ρ=1,032 г/см3) из раствора с массовой долей 40% (ρ=1,308 г/см3). Сколько нужно взять исходного раствора и воды?
Решение. Решаем по правилу креста. В диагональную схему сразу водим плотности. Плотность воды равна 1 г/см3. Тогда разность большего и меньшего значений будет равна объему (см3).
| 1,308 г/см3 (40% раствор) | 0,032 см3 40% раствора | |
| 1.032 г/см3 (5% раствор) | ||
| 1 г/см3 (вода) | 0,276 см3 воды |
Находим суммарный объем полученного раствора: 0,032 + 0,276 = 0,307 см3
Составляем пропорцию для нахождения объема исходного 40% раствора:
0,307 см3 – 0,032 см3
100 см3 - Х 
Следовательно, для приготовления 100 см3 5% раствора необходимо взять 100-10,4 = 89,6 см3 воды и 10,4 см3 40% раствора гидроксида калия.
Пример 4. Определите титр (г/см3) раствора гашеной извести с молярной концентрацией гидроксида кальция 0,01 моль/дм3.
Решение. Находим массу гидроксида кальция из формулы:
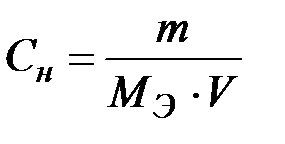 ;
; 
Находим титр раствора:

Пример 5. Найдите массу воды и медного купороса (CuSO4 · 5H2O), необходимого для приготовления 1 дм3 раствора, содержащего 8% безводной соли (ρ = 1,084 г/см3).
Решение. Находим массу полученного раствора:

Молярная масса CuSO4 · 5H2O равна 249,7 г/моль
Молярная масса CuSO4 равна 159,6 г/моль
Составляем пропорцию: 249,7 г CuSO4 · 5H2O – 159,6 г CuSO4
Х - 86,7 г

Для приготовления 1 дм3 раствора медного купороса нужно 135,6 г кристаллогидрата CuSO4 · 5H2O и 1084-1354,6 = 948,4 г воды.
Пример 6. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н раствора щелочи. Чему равна молярная концентрация эквивалентов кислоты?
Решение. Вещества взаимодействуют в эквивалентных количествах. По закону эквивалентов при разных молярных концентрациях эквивалентов объемы растворов реагирующих веществ обратно пропорциональны их нормальностям:  ; СН = 0,25 н
; СН = 0,25 н
Дата публикования: 2014-11-18; Прочитано: 1326 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
