 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Эквивалент. Закон эквивалентов
|
|
Эквивалент (Э) – это реальная ли условная частица вещества, которая может присоединять, замещать, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях.
При определении эквивалента вещества необходимо исходить из конкретной реакции.
Например: Из уравнения реакции кислотно-основного характера  .
.
Следует, что одному иону водорода соответствует одна молекула  и одна
и одна  ,
,  молекулы
молекулы  и
и  молекулы
молекулы  , поэтому Э(
, поэтому Э( )=
)=  , Э(
, Э( )=
)=  (это реальные частицы); Э(
(это реальные частицы); Э( )=
)= 
 , Э(
, Э( )=
)= 
 (это условные частицы).
(это условные частицы).
Из окислительно-восстановительной реакции
2KMnO4 + 5Na2SO3 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2|MnO4- + 8H+ + 5  → Mn2+ + 4H2O - окислитель, реакция восстановления
→ Mn2+ + 4H2O - окислитель, реакция восстановления
5| SO32- + H2O + 2  → SO42- + 2H+ - восстановитель, реакция окисления
→ SO42- + 2H+ - восстановитель, реакция окисления
Следует, что одному электрону соответствует 1/5 молекула KMnO4 и ½ молекула Na2SO3, поэтому Э(окислителя) = 1/5, Э(восстановителя) = ½.
Аналогично, эквивалент в реакциях обмена и замещения равен моль веществу, деленный на количество замещенных частиц.
Таким образом, эквивалент вещества не является постоянной величиной, она зависит от реакции, в которой участвует данное вещество.
Моль эквивалентов – количество вещества, содержащего 6,022×1023 эквивалентов. Масса одного моля эквивалентов вещества (элемента) называют молярной массой эквивалентов вещества ( ), г/моль.
), г/моль.
Например:  ;
;


Число, обозначающее какая доля от реальной частицы эквивалентно одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях, называют фактором эквивалентности (fэ).
Например: Врассмотренных примерах: fэ( )=1; fэ(
)=1; fэ( )=
)=  ; fэ(
; fэ( )=
)=  .
.
Закон эквивалентов (И.В. Рихтер, 1809 г)
Химические элементы или вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
 (6)
(6)
где  и
и  - массы веществ, г.,
- массы веществ, г.,  и
и  - молярные массы эквивалентов веществ, г/моль,
- молярные массы эквивалентов веществ, г/моль,  и
и  - эквиваленты веществ, моль.
- эквиваленты веществ, моль.
Если одно из веществ или оба вещества, вступивших или получившихся в результате реакции, находится в газообразном состоянии, закон эквивалентов принимает вид:
 или
или  (7)
(7)
где  - масса твердого или жидкого вещества, г.,
- масса твердого или жидкого вещества, г.,  - молярная масса эквивалента твердого (жидкого) вещества, г/моль,
- молярная масса эквивалента твердого (жидкого) вещества, г/моль,  ,
,  - объем газообразного вещества (н.у.), л,
- объем газообразного вещества (н.у.), л,  ,
,  -молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
-молярный объем эквивалента газообразного вещества (н.у.), л/моль (дм3/моль).
Молярный объем эквивалента вещества ( ) – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
) – это объем, занимаемый одним эквивалентом газообразного вещества при нормальных условиях.
Поскольку 1 моль любого газа при нормальных условиях занимает объем 22,4 л, то молярный объем эквивалента газообразного водорода будет равняться 11,2 л/моль, а кислорода – 5,6 л/моль.
Молярная масса эквивалентов элемента в соединении не является величиной постоянной. Она зависит от валентности элемента в данном соединении и выражается уравнением:
 ,
,  (8)
(8)
где  - молярная масса элемента, г/моль;
- молярная масса элемента, г/моль;  - валентность элемента в данном соединении, fэ – фактор эквивалентности.
- валентность элемента в данном соединении, fэ – фактор эквивалентности.
Молярные массы эквивалентов сложных веществ рассчитываются по следующим формулам:

 ,
,  (9)
(9)
 - молярная масса кислоты,
- молярная масса кислоты,  - число атомов водорода вступивших в реакцию.
- число атомов водорода вступивших в реакцию.
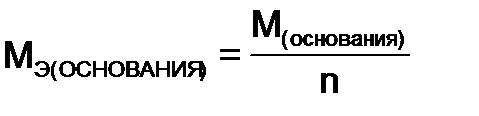 ,
,  (10)
(10)
 - молярная масса основания,
- молярная масса основания,  - число гидроксильных групп в основании, вступивших в реакцию.
- число гидроксильных групп в основании, вступивших в реакцию.
 ,
,  (11)
(11)
 - молярная масса соли,
- молярная масса соли,  - число атомов металла образующего соль;
- число атомов металла образующего соль;  - валентность металла.
- валентность металла.
 ,
,  (12)
(12)
 - молярная масса оксида,
- молярная масса оксида,  - число атомов элемента образующего оксид,
- число атомов элемента образующего оксид,  - валентность этого элемента.
- валентность этого элемента.
Контрольные вопросы и задания
1. Что называется химическим эквивалентом?
2. Сформулируйте закон эквивалентов.
3. Как вычисляют эквиваленты элементов, оксидов, оснований, кислот, солей? Приведите примеры.
4. Определите эквивалент серы в соединениях: H2S, SO2, H2SO3, H2SO4.
5. Что такое моль эквивалентов и молярная масса эквивалентов?
6. Вычислите молярные массы эквивалента следующих веществ в реакциях обмена: KOH, H2S, H2SO4, Ca(OH)2, NH4OH, CuSO4. Составьте уравнения реакций.
7. Определите эквивалент двухвалентного металла, если 0,0977 г этого металла вытесняет 28 мл водорода при н.у.
8. При взаимодействии 0,5 г кальция с водородом образовалось 0,525 г гидрида кальция. Вычислите молярную массу эквивалента кальция и его эквивалент.
9. Вычислите молярную массу эквивалента металла, зная, что его хлорид содержит 79,78% хлора. Молярная масса эквивалента хлора равна 35,5 г/моль.
10. 0,304 г. Магния вытеснили 0,28 л водорода из соляной кислоты. Вычислите эквивалент магния и молярную массу его эквивалента.
1.3. Примеры решения задач
Пример 1. Распределите соединения по классам и определите характер, назовите их:  ,
,  ,
,  ,
, 
Решение. Представим результаты в виде таблицы (13).
Таблица 13
| Соединение | Класс | Химический характер | Название |

| оксид | основной | оксид кальция |

| гидроксид | кислотный | азотистая кислота |

| соль | средняя (нормальная) | хлорат калия |

| гидроксид | амфотерный | гидроксид бериллия |
Пример 2. Докажите химический характер  и
и  с помощью реакций.
с помощью реакций.
Решение.  – оксид кальция, основной оксид. Реагирует с кислотой и кислотными оксидами:
– оксид кальция, основной оксид. Реагирует с кислотой и кислотными оксидами:

 – гидроксид бериллия. Обладает как основными, так и кислотными свойствами:
– гидроксид бериллия. Обладает как основными, так и кислотными свойствами:
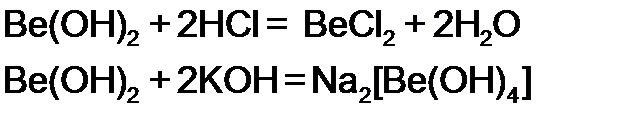
Пример 3. Осуществите превращение: напишите уравнения реакций, укажите условия протекания процесса, дайте названия соединениям:

Решение. 




Пример 4. Рассчитайте молярную массу эквивалентов серы в соединениях  .
.
Решение Расчет ведем по формуле (8):
а) SO2 – оксид серы, валентность серы в данном соединении равна 4
МЭ(S) = 32/ 4 = 8 г/моль
б) H2SO4 – серная кислота, валентность серы в данном соединении равна 6
МЭ(S) = 32/ 6 = 5,33 г/моль
в) H2S – сероводород, валентность серы в данном соединении равна 2
МЭ(S) = 32/ 2 = 16 г/моль
Пример 5. Рассчитайте молярные массы эквивалентов (Мэ) следующих веществ 
Решение.  - гидроксид кальция, основание. Расчет ведем по формуле (10):
- гидроксид кальция, основание. Расчет ведем по формуле (10):
 = 40 + 2·(16 + 2) = 76 г/моль
= 40 + 2·(16 + 2) = 76 г/моль
Так как в молекуле  , имеются две гидроксидные группы (ОН), то в случае замещения в реакции одной из них n = 1
, имеются две гидроксидные группы (ОН), то в случае замещения в реакции одной из них n = 1  = 76/1= 76 г/моль, а двух, n = 2
= 76/1= 76 г/моль, а двух, n = 2  ) = 76/ 2 = 38 г/моль
) = 76/ 2 = 38 г/моль
 – серная кислота. Расчет ведем по формуле (9):
– серная кислота. Расчет ведем по формуле (9):
 = 2 + 32 + 16·4 = 98 г/моль,
= 2 + 32 + 16·4 = 98 г/моль,
Так как в кислоте два атома водорода, то в случае замещения одного n = 1,  =98/1 =98 г/моль, а двух n = 2,
=98/1 =98 г/моль, а двух n = 2,  ) = 98/ 2 = 49 г/моль.
) = 98/ 2 = 49 г/моль.
 –нитрат магния, соль. Расчет ведем по формуле (11):
–нитрат магния, соль. Расчет ведем по формуле (11):
 = 24 + 2·(14 + 16·3) = 148 г/моль; n = 1 (количество атомов металла), Z = 2 (валентность металла)
= 24 + 2·(14 + 16·3) = 148 г/моль; n = 1 (количество атомов металла), Z = 2 (валентность металла)
 = 148/ 2 = 74 г/моль
= 148/ 2 = 74 г/моль
 – оксид алюминия. Расчет ведем по формуле (12):
– оксид алюминия. Расчет ведем по формуле (12):
 = 27·2 + 16·3 = 102 г/моль; n = 2 (количество металла), Z = 3 (валентность металла)
= 27·2 + 16·3 = 102 г/моль; n = 2 (количество металла), Z = 3 (валентность металла)
 = 102 / 6 = 17 г/моль
= 102 / 6 = 17 г/моль
Пример 6. При сгорании металла образуется 9,43 г его оксида. Молярная масса эквивалента оксида металла равно 17 г/моль. Какая масса металла вступала в реакцию?
Решение. Учитывая, что  , можно найти молярную массу эквивалентов металла:
, можно найти молярную массу эквивалентов металла:  г/моль, по закону эквивалентов формула (4) найдем количество металла, вступившего в реакцию: m (металла)= 9,43×9/ 17=4,99 г
г/моль, по закону эквивалентов формула (4) найдем количество металла, вступившего в реакцию: m (металла)= 9,43×9/ 17=4,99 г
Пример 7. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалентов оксида и молярную массу эквивалентов металла.
Решение. Молярная масса водорода равная 2 г/моль при н.у. занимает объем 22,4 л, то объем молярной массы эквивалентов водорода (1 г/моль) будет равен 22,4: 2 = 11,2 л
По закону эквивалентов формула (5): 
 = 7,09·11,2 / 2,24 = 35,45 г/моль
= 7,09·11,2 / 2,24 = 35,45 г/моль
Согласно закону эквивалентов  =
=  -
-  =35,45–8=27,45 г/моль.
=35,45–8=27,45 г/моль.
Пример 8. Сколько металла, эквивалентная масса которого 12,16 г/моль, взаимодействует с 310 мл кислорода (н.у.)?
Решение. Молярная масса кислорода равная 32 г/моль при н.у. занимает объем 22,4 дм3, то объем молярной массы эквивалентов кислорода (8 г/моль) будет равен 22,4: 4 = 5,6 л = 5600 мл.
По закону эквивалентов формула (7):  ;
;  =
= 
Отсюда  = 310·12,16: 5600 = 0,673 г
= 310·12,16: 5600 = 0,673 г
Пример 9. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла.
Решение. Молярная масса эквивалента химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
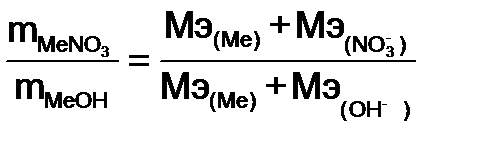 ;
;
Молярная масса эквивалентов иона (катиона, аниона) равна отношению молярной массе иона к величине заряда иона.

 = 15 г/моль.
= 15 г/моль.
Пример 10. Определить при н.у. объем азота собранного над водой при 20 0С и Р = 100 кПа. Рводяного пара = 2,3 кПа, Объем азота равен 120 см3.
Решение. Разота = Р – Рводяного пара = 100 – 2,3 = 97,7 кПа. По формуле (4) объем азота равен:  .
.
Дата публикования: 2014-11-18; Прочитано: 11318 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
