 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретические сведения. Раствор –гомогенная термодинамически устойчивая система, состоящая из растворенного вещества, растворителя и продуктов их взаимодествия
|
|
Раствор – гомогенная термодинамически устойчивая система, состоящая из растворенного вещества, растворителя и продуктов их взаимодествия. Компонент, агрегатное состояние которого не изменяется при образовании раствора, называется растворителем, а другой компонент – растворенным веществом. При одинаковом агрегатном состоянии компонентов растворителем считают то вещество, которое преобладает.
Основной характеристикой раствора является его состав, который выражается концентрацией.
Концентрация раствора – содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя.
Концентрацию выражают через безмерные величины – доли и через размерные величины – молярные массы.
Массовая доля вещества (ɷ) – это отношение массы вещества к общей массе раствора. Она выражается в %, показывает, сколько граммов данного компонента содержится в 100 г раствора.
 (13)
(13)
Часто приходится проводить расчеты, связанные с разбавлением растворов смешиванием. Если при смешивании нескольких растворов одного и того же вещества с различной процентной концентрацией (А%, В%) учитывались их массовые числа (а, б), то для определении концентрации вещества (С %) в смеси расчет проводят по формуле:
аА+вВ = (а+в)Х, (14)
где а и в – массы растворов, А, В, Х – концентрации растворов, %.
На практике при вычислении массовых отношений между смешиваемыми растворами пользуются приемом («правило крета»):
| ɷ1 | ɷХ - ɷ2 – m раствора с массовой долей ɷ1 | |
| ɷХ | ||
| ɷ2 | ɷ1 - ɷХ - m раствора с массовой долей ɷ2 |
ɷ1 и ɷ2 - концентрации исходных веществ, ɷХ – концентрация полученного раствора.
Тем же методом можно пользоваться и при разбавлении растворов водой. Соответствующая воде массовая доля принимается равной нулю.
Молярная доля растворенного вещества (N(A)) – это отношение числа моль растворенного вещества к сумме моль растворенного вещества и растворителя. Если в системе содержится несколько веществ, то это отношение числа моль искомого вещества к общему числу моль всех содержащихся в системе веществ:
 (15)
(15)
Молярная доля растворителя (N(В)) – это отношение числа моль растворителя к сумме моль растворенного вещества и растворителя:
 (16)
(16)
Молярная концентрация (СМ) - это отношение количества растворенного вещества к объему его раствора. Показывает сколько моль вещества содержится в 1 дм3 (л) раствора:
 ; [моль/дм3] (17)
; [моль/дм3] (17)
Растворы с молярной концентрацией атомов, молекул, ионов называются молярными. При этом пользуются следующей формой записи, где «М» обозначается молярность:
СМ(НСl) = 1 моль/дм3 – молярный раствор, 1М раствор НСl;
СМ(НСl) = 0,1 моль/дм3 – децимолярный раствор, 0,1М раствор НСl;
СМ(НСl) = 0,01 моль/дм3 –сантимолярный раствор, 0,01М раствор НСl;
СМ(НСl) = 0,001 моль/дм3 – миллимолярный раствор, 0,001М раствор НСl и т.д.
Нормальная (эквивалентная) или молярная концентрация эквивалента (Сн) – это число моль эквивалента вещества в 1 дм3 раствора. Условно применяется следующее обозначение Сн (НСl) = 1 моль/дм3 или 1н раствор НСl.
 ; [моль/дм3] (18)
; [моль/дм3] (18)
Если численные значения молярной и нормальной концентрации совпадают (э = 1), то употребляют слово «молярная». Например, для 2М раствора КОН не нужно применять выражение 2н раствор КОН.
Моляльная концентрация (Сm) – это число моль вещества, растворенного в 1 кг растворителя:
 ; [моль/кг] (19)
; [моль/кг] (19)
Концентрация – титр (Т) – отношение массы растворенного вещества к объему его раствора:
 ; [г/см3] или [г/мл] (20)
; [г/см3] или [г/мл] (20)
СМ, Сн, Т зависят от температуры, так как при нагревании объем раствора увеличивается.
Практически используется еще одной массовой величиной – плотностью раствора (ρ) – отношение массы раствора к его объему:
 ; [г/см3] или [г/мл] (21)
; [г/см3] или [г/мл] (21)
В практике приготовления растворов пользуются формулами пересчета одной концентрации в другую:
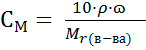 (22)
(22)  (23)
(23)
 (24)
(24) 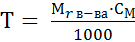 г/см3 (25)
г/см3 (25)
 г/см3 (26)
г/см3 (26)
Контрольные вопросы и задания
1. Дайте определение понятий: раствор, растворитель, растворенное вещество, растворимость.
2. Дайте определение понятий: насыщенные, ненасыщенные, перенасыщенные растворы.
3. Что называется концентрацией раствора?
4. Способы выражения концентрации раствора.
5. Какая связь между молярной, нормальной и процентной концентрацией?
6. Охарактеризуйте правило смешения растворов и его разновидность – «правило креста».
Дата публикования: 2014-11-18; Прочитано: 1481 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
