 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Алкени – вуглеводні, в молекулах яких є один подвійний зв’язок між атомами вуглецю . Алкені називають також олефінами або етиленовими вуглеводнями
|
|
Етилен. Найпростішим алкеном є етилен 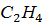 . За міжнародною номенклатурою назва етилену – етен. Структурна формула молекули етилену має такий вигляд:
. За міжнародною номенклатурою назва етилену – етен. Структурна формула молекули етилену має такий вигляд:
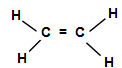
Розглянемо природу зв’язків у молекулі 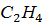 з позицій сучасної електронної теорії. В атому вуглецю, який знаходиться в збудженому стані (
з позицій сучасної електронної теорії. В атому вуглецю, який знаходиться в збудженому стані ( ), гібридизації можуть зазнати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві p- орбіталі. Третя p- орбіталь з неспареним електроном залишається в незмінному вигляді. Такий тип гібридизації (s
), гібридизації можуть зазнати не всі, а тільки три орбіталі зовнішнього рівня: одна s- і дві p- орбіталі. Третя p- орбіталь з неспареним електроном залишається в незмінному вигляді. Такий тип гібридизації (s  – гібридизація) спостерігається при утворенні молекули етилену
– гібридизація) спостерігається при утворенні молекули етилену 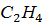 .
.
Подвійний зв’язок у молекулі етилену складається з одного  - і одного π- зв’зків. Подвійний зв’язок міцніший від одинарного, але не в два рази.
- і одного π- зв’зків. Подвійний зв’язок міцніший від одинарного, але не в два рази.
Гомологи етилену. Етилен 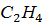 – перший член гомологічного ряду алкенів. Послідовно додаючи до формули гомологічну різни
– перший член гомологічного ряду алкенів. Послідовно додаючи до формули гомологічну різни  можна одержати формули гомологів етилену: С3Н6, С4Н8, С5Н10 і т.д. Загальна формула вуглеводнів ряду алкенів СnH2n, де n=2,3,4…
можна одержати формули гомологів етилену: С3Н6, С4Н8, С5Н10 і т.д. Загальна формула вуглеводнів ряду алкенів СnH2n, де n=2,3,4…
Ізомерія. Для алкенів характерні два види ізомерії. Структурна ізомерія пов’язана з різним положенням подвійного зв’язку у вуглеводневому ланцюгу і з розгалуженням ланцюга. Наприклад, бутен має такі ізомери:
 ;
;  ;
; 
Назви алкенів утворюються так. Вибирають найдовший вуглеводневий ланцюг, який містить подвійний зв’язок. Нумерують атоми вуглецю в цьому ланцюгу, починаючи з того кінця, до якого ближче розміщений подвійний зв’язок. За основу назви ізомера беруть назву алкену, що відповідає головному ланцюгу. Наприклад: бутен, якщо головний ланцюг містить 4 атоми вуглецю, пентан – 5 атомів С, октен – 8 атомів С.
Другий характерний вид ізомерії вуглеводнів з подвійним зв’язком – це просторова ізомерія або стереоізомерія. Вона зумовлена різним положенням замісників відносно площини, в якій розміщені подвійні зв'язки. Для позначення стереоізомерів алкенів використовують префікси цис- і транс-. У молекулі цис- ізомеру алкільні радикали розміщені по один бік від площини подвійного зв'язку, в молекулі транс- ізомеру- по різні боки.
Цис- і транс- ізомери різняться за властивостями. Наприклад: температура кипіння цис- бутену-2 дорівнює 3,7°С, а транс-бутену-2 - +1°С.
Сполуки з подвійним зв'язком вуглець-вуглець можуть мати циклічну будову. Ці сполуки належать до циклоалкенів. Циклоалкени не є гомологами етилену.
Властивості алкенів. Етен, пропен і бутени - це безбарвні гази. Алкени нормальної будови від С5Н10 до С18Н36 - рідини, а починаючи з С19Н38 - тверді речовини. Алкени мало розчинні у воді, густина їх менша від 1г/см.
На відміну від алканів етилен і його гомологи виявляють високу реакційну здатність, що зумовлено наявністю в їхніх молекулах подвійного зв'язку. Алкени здатні вступати в реакції приєднання за рахунок розриву π-зв'язку. Крім того, π-зв'язок під дією окислювачів руйнується легше, ніж σ-зв'язок, тому для алкенів характерна участь у ролі відновників в окислювального-відновних реакціях.
1. Гідрування. Приєднуючи водень, алкени переходять у алкани:
СН2 = СН2 + Н2 → СН3 – СН3
Реації гідрування алкенів відбуваються при наявності каталізаторів (платини, паладію, нікелю).
2. Галогенування. Алкени легко приєднують галогени, особливо хлор і бром:

На цій реакції базується якісне визначення ненасичених сполук: бромна вода під час пропускання крізь неї етилену та інших алкенів знебарвлюється.
3. Гідрогалогенування. Галогеноводні також легко приєднуються до алкенів, наприклад:
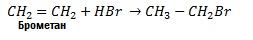
Ця реакція є гетеролітичною, що відбувається з утворенням іонів в результаті гетеролітичного розриву подвійного зв’язку. Подвійний зв’язок має підвищену електронну густину, тому він легко приєднує електрофільні частинки.
Молекула HBr може відщеплювати іон водню  , який виступає як електрофільна частинка. Іон водню взаємодіє з молекулою етилену, при цьому утворюється органічний катіон, який далі реагує з бромід-іонами:
, який виступає як електрофільна частинка. Іон водню взаємодіє з молекулою етилену, при цьому утворюється органічний катіон, який далі реагує з бромід-іонами:

Приєднання галогеноводнів до гомологів етилену може відбуватися двома шляхами, наприклад: 
Під час цієї реакції утворюється переважно 2-бромбпоропан. Вивчення подібних реакцій дало змогу російському хіміку В.В.Морковникову сформувати таке правило: атом водню галогеноводнів та інших несеметричних водневих сполук приєднується до найбільш гідрогенізованого атома вуглецю біля подвійного зв’язку (тобто до атома вуглецю, який сполучений з великою кількістю атомів водню).
4. Гідрація. Під час гідрації алкенів при наявності каталізаторів (сірчаної кислоти чи інших) утворюють спирти; приєднання води до гомологів етилену відбувається з правилом Морковникова, наприклад:

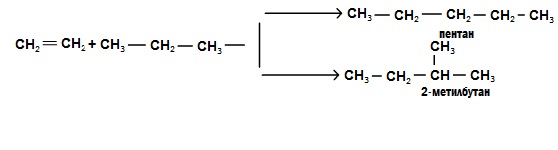
5. Алкінування. Алкени можуть приєднувати насичені вуглеводні з утворенням вищих алканів. Реакції алкілування відбуваються при наявності каталізаторів (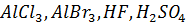 ). Наприклад, під час взаємодії етилену з пропаном утворюються два нових алкани:
). Наприклад, під час взаємодії етилену з пропаном утворюються два нових алкани:
6. Полімеризація. Молекули алкенів можуть сполучатися одна з одною з утворенням макромолекули з розімкненням π- зв’яком.
7. Окислення. Алкени легко окислюються, при чому залежно від сили окмслювачів реакції можуть відбуватися з розривом тільки π- зв’язку або з повним розривом подвійного зв’язку.
Перманганат калію в нейтральному і слабко лужному середовищах окислює алкени розімкненням π-зв’язку. Цю реакцію можна зобразити схемою:

Якщо алкени пропускати крізь водний розчин перманганату калію, то відбування забарвлення розчину. Цю реакцію, як і реакцію бромування використовують для якісного визначення алкенів.
Сильні окиснювачі (перманганат калію або дихромат калію при наявності сірчаної кислоти) окислюють алкени з розривом молекули за місцем подвійного зв’язку. В результаті утворюються різні кисневмісні органічні сполуки, наприклад:

Під час високотемпературного окислення алкенів у кисні або на повітрі вони згорають:

В результаті завжди утворюються оксид вуглецю (IV) і вода.
Добування алкенів. Лабораторним способом добування етилену та його гомологів є дегідратація (відщеплення води) спиртів при наявності концентрованої сірчаної кислоти чи інших водовідбірних агентів. Так, етилен можна добути з етиленового спирту при нагріванні його з сірчаною кислотою:

У промисловості алкени добувають з насичених вуглеводнів під час термінового розкладання (крекінгу) нафти, наприклад:
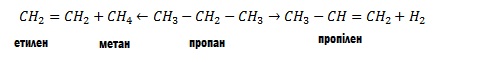
Інший промисловий спосіб добування алкенів базується на дегідруванні (відщеплення водню) алканів при наявності каталізаторів, наприклад нікелю:

Застосування алкенів. Етилен та інші алкени є важливою сировиною для хімічної промисловості. З етилену, пропілену виробляють пластмаси – поліетилен і поліпропілен. Етилен є вихідною речовиною для промислового добування багатьох органічних речовин.
Алкілуванням алкенів добувають насичені вуглеводні, які використовують як моторне паливо.
Етилен прискорює достигання деяких плодів, для чого його вводять в атмосферу сховищ, де знаходяться недостиглі овочі та фрукти. Етилен також запобігає передчасного скиданню плодів рослинами в теплицях.
Дата публикования: 2014-11-18; Прочитано: 3480 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
