 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Дефекты кристаллического строения
|
|
В реальных металлах, применяемых в технике, кристаллические решетки имеют ряд несовершенств или дефектов, т. е. отклонения от правильного геометрического строения. Характер и степень нарушения правильности кристаллического строения определённым образом сказываются на свойствах металлов. Эти дефекты по геометрическим признакам подразделяют на точечные, линейные и поверхностные. К точечным дефектам относят вакансии и дислоцированные (межузельные) атомы.
Известно, что атомы находятся в колебательном движении около узлов решетки. Большинство атомов металла в данной решетке обладает одинаковой энергией (средней), однако отдельные атомы имеют энергию, превосходящую среднюю и могут перемещаться из одного места в другое. Такие атомы, особенно расположенные ближе к поверхности, выходят на эту поверхность, а их место могут занять атомы, находящиеся дальше от поверхности.
Освободившееся место, где находился переместившийся атом, называется вакансией (рис. 1.4, а) или дефектом Шотки. Число вакансий увеличивается с повышением температуры, при обработке давлением, облучении и других видах обработки. Вакансии играют важную роль в диффузионных процессах, происходящих в металлах и сплавах при повышенных температурах. Перемещение атомов какого-либо элемента в металле называется диффузией. Явление перемещения атомов элемента в его собственной решетке называется самодиффузией.
Включение в кристаллическую решетку атома другого элемента также изменяет ее совершенное строение (см. рис. 1.4, б).
Вышедший из положения равновесия атом называют дислоцированным (межузелным, рис. 1.4, в) или дефектом Френкеля. Вакансии и дислоци-рованные атомы представляют собой точечные дефекты кристаллической решетки и являются причиной ее искажения. Дислоцированный атом и вакансии не остаются неподвижными, они перемещаются по решетке.
Точечные дефекты приводят к искажению кристаллической решетки

| Рис. 1.4. Искажение кристаллической решетки около: а - вакансии; б - внедренного атома; в – дислоциро-ванного атома |
Линейные дефекты называются дислокациями. Различают два вида дислокаций—краевые и винтовые. Краевая дислокация (рис. 1.5) представляет собой местное искажение кристаллической решетки; винтовая дислокация (рис.1.6) образуется при неполном сдвиге кристалла по плоскости. Дислокации образуются в процессе кристаллизации, при термической и химико-термической обработках, пластической деформации и других видах воздействий на структуру сплавов.

| 
|
| Рис. 1.5. Краевая дислокация | Рис. 1.6. Винтовая дислокация |
На свойства металлов влияет не только плотность дислокаций, но и их расположение в объеме. Поверхностные дефекты представляют собой поверхности раздела между отдельными кристаллитами или их блоками. На границах зерен расположение атомов менее правильное, чем в зерне.
Вакансии, дислокации и другие дефекты атомно-кристаллического строения оказывают существенное влияние на свойства металлов и сплавов.
Наличие несовершенств (дефектов) в атомно-кристаллических решетках реальных металлов объясняет некоторые особенности их механических и физических свойств и, в частности, то обстоятельство, что реальные металлы имеют прочность, во много раз меньшую, чем они должны иметь теоретически.
Основным фактором, определяющим уровень механических свойств металлов, является количество и характер распределения дефектов кристал-лического строения. Когда их сравнительно много, появляется упрочняющее действие (рис. 1.7).

| Рис.1.7. Зависимость прочности от количества дефектов кристаллического строения |
Предел прочности современных конструкционных сталей, достигнутый легированием и термической обработкой, составляет 1766…2158 МПа (180…220 кгс/мм2), а нитевидных кристаллов (практически без дефектов) чистого железа равен 13106 МПа (1336 кгс/мм2).
1/5
. Понятие о кристаллизации. Металлы и сплавы в зависимости от температуры нагрева могут находиться в трёх агрегатных состояниях: в твёрдом, жидком и газообразом[6]. При переходе металла из жидкого состояния в твердое образуются кристаллы. Такой процесс называют кристаллизацией.
Жидкость отличается от твердого тела, прежде всего тем, что она не может сопротивляться сдвигу и поэтому способна растекаться по поверхности твердого тела, например в полости литейной формы.
В чистых металлах твердое состояние переходит в жидкое при температуре плавления, жидкое в газообразное при температуре кипения. Температура плавления Tпл металлов колеблется от —39 °С (для ртути, самого легкоплавкого металла) до +3390 °С (для самого тугоплавкого металла вольфрама).
Основной причиной и движущей силой процесса перехода металла из жидкого состояния в твёрдое, т. е. процесса кристаллизации или при переходе из одной аллотропической формы в другую является стремление вещества к наиболее устойчивому в термодинамическом отношении состоянию, т. е. к наименьшему запасу свободной энергии. Свободная энергия характеризуется определённым запасом внутренней энергии, которая складывается из энергии движения молекул, атомов, электронов, энергии упругих искажений кристаллической решётки и др. Кристаллизация, как и любой самопроизвольно текущий процесс идёт только в том случае, если новое состояние более устойчиво, т. е. обладает меньшим запасом свободной энергии.
На рис. 1.8 приведены кривые, которые характеризуют изменение свободной энергии жидкого Fж и твёрдого Fт металла в зависимости от температуры. Выше температуры Тsменьшей свободной энергией обладает вещество в жидком состоянии, ниже Тs – вещество в твёрдом состоянии. Следовательно, выше температуры Тs сплавы должны находиться в жидком состоянии, а ниже – в твёрдом. При температуре Тs свободные энергии жидкого F ж и F т состояний равны, металл в обоих состояниях находятся в равновесии. Температура, при которой свободные энергии жидкого и твёрдого состояний одинаковы, называется теоретической температурой кристаллизации.
|
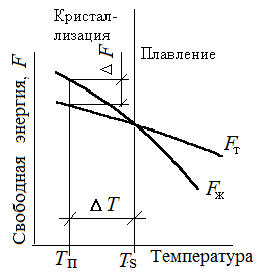
Однако при Тsне может происходить кристаллизация, поскольку F ж = F т.
Процесс кристаллизации возможен лишь при наличии некоторой разности свободных энергий DF, т. е. F т < F ж. Реальная кристаллизация начинается при температуре ниже теоретической, когда свободная энергия твердой фазы станет меньше свободной энергии жидкой фазы (F т< F ж). При этом произойдет самопроизвольное уменьшение энергии на величину ∆ F. Температура, при которой практически начинается кристаллизация, называется фактической температурой кристаллизации. Разность между теоретической T s и фактической T п температурами кристаллизации называется степенью переохлаждения ∆ t.
Чем сильнее степень переохлаждения, тем больше будет разность свободных энергий (F ж – F т).
4.2. Кривые охлаждения. Процесс кристаллизации металла можно изобразить кривыми в координатах время – температура (рис. 1.11), которую получают экспериментально.


Кривая показывает, что температура жидкого металла до точки 1понижается почти равномерно. Когда металл охладится до некоторой температуры Ts (рис. 1.11, а, точка 1), начинается кристаллизация, дальнейшее падение температуры прекратится, несмотря на непрерывную отдачу тепла окружающей среде. Следовательно, в металле идет процесс выделения тепла. Выделяющееся при процессе кристаллизации тепло называется скрытой теплотой кристаллизации.
К моменту, соответствующему точке 2, кристаллизация заканчивается, весь металл перейдет из жидкого в твердое состояние и далее температура будет опять постепенно понижаться. В реальных условиях металл, охладившись до температуры Тs, еще не начнет кристаллизоваться, а останется некоторое время жидким (рис. 1.11, б). В это время металл переохлаждается до некоторой температуры Тп, начинается интенсивная кристаллизация. Разность температур (Ts — Тп) и есть степень переохлаждения. Она зависит от природы сплава, его чистоты и скорости охлаждения. Чем больше скорость охлаждения, тем больше степень переохлаждения. Петля на кривой охлаждения (рис. 1.11, б) показывает, что кристаллизация сопровождается выделением тепла, которое повышает температуру сплава до Ts, поддерживая ее до полного затвердевания металла.
Механизм процесса кристаллизации. Для выяснения принципиальных различий между твёрдым и жидким состоянием рассмотрим сущность процесса плавления. Атомы в узлах кристаллической решётки всегда совершают колебательное движение, причём с огромной частотой порядка 1013 периодов в секунду. С повышением температуры амплитуда колебаний атомов (размах) возрастает. Колеблющиеся атомы сталкиваются друг с другом, подобно упругим шарам, причём тем сильнее, чем выше температура. При достижении определённой температуры энергия столкновений становится настолько большой, что атомы “выбивают” друг друга из положения равновесия в узлах кристаллической решётки, и кристаллическая решётка разрушается.
Таким образом, сущностью процесса плавления является разрушение кристаллического строения при повышении температуры, а непременным условием твёрдого состояния является кристаллическое строение.
Подобное представление о строении жидкого состояния является упро-щённым. Разрушение кристаллической решётки при плавлении металла ещё не означает полного уничтожения упорядоченности в расположении атомов. Атомные связи при плавлении ослабляются сравнительно немного, и относительное размещение ближних атомов почти сохраняется.
В. И. Данилов путём рентгеноструктурного анализа доказал, что при температурах незначительно превышающих температуру плавления в жидком расплаве сохраняется всё же некоторое упорядоченное расположение атомов в отдельных микрообъёмах (подобно порядку в кристаллическом теле), так называемый ближний порядок. Дальний порядок характеризует размещение атомов в узлах кристаллической решётки, а ближний порядок – правильность расположения ближних соседей данного атома, т. е. небольшой группы атомов. Чем ниже температура, тем большее развитие получают группировки атомов. Группировки атомов ближнего порядка являются основой для зарождения будущих центров кристаллизации, способных к дальнейшему росту. Установлено, что не все первоначально образованные центры кристаллизации способны к росту. Они могут возникать в определённых объёмах, существовать некоторое время, разрушаться и вновь возникать в другом месте. Время, в течение которого группировки могут существовать, зависит от так называемой энергии активации, которая представляет работу, необходимую для преодоления энергетического барьера при выходе данного атома из своего атомного окружения, где он имел избыток свободной энергии. Наглядно это представляется в виде схемы (рис. 1.9): шарик (атом) из положения 1, стараясь снизить свою потенциальную энергию, скатывается вниз занимая положение 2, затем он должен раскачаться и перескочить барьер высотой Dh1 и перейти в более низкое положение 3.

| Рисунок 1.9 – Положение шарика в стабильном 2 и 3 и в неравновесном, (нестабильном) состоянии 1. |
Чем ниже высота Dh1 этого барьера, т.е. чем ниже энергия активации, тем легче атому перескочить в другое положение.
Таким образом, в процессе кристаллизации происходит сначала зарождение центров («зародышей») кристаллизации в жидком расплаве, а затем линейный рост кристаллов из этих центров. Центрами кристаллизации могут быть устойчивые группировки атомов, тугоплавкие частицы примесей и др. На рис. 1.10 показана схема роста зерен при кристаллизации чистых металлов, предложенная Иосифом Львовичем Миркиным. В первые моменты кристаллы растут свободно, сохраняя правильную геометрическую форму, так как их образованию еще не препятствуют соседние кристаллы.


По мере роста кристаллов количество жидкого металла (расплава) уменьшается, происходит столкновение растущих кристаллов, в результате чего искажается их правильная геометрическая форма. Такие кристаллы называются кристаллитами, полиэдрами или зернами.
От степени переохлаждения (Δ Т) зависит скорость образования зародышей V з(центров кристаллизации) и скорость роста кристаллов V р (зерен). С увеличением переохлаждения возрастают скорости обоих процессов, достигая максимального значения при определенных степенях переохлаждения, и затем замедляются (рис. 1.12). Число зарождающихся в единицу времени зародышей имеет размерность мм3·с (число зародышей, возникающих в 1 мм3 за одну секунду).

|
Рис. 1.12. Влияние степени переохла-ждения на: 1) скорость образования зародышей V з и скорость роста кристаллов V р (а);
2) размеры устойчивых зародышей
( ‒ б);
3) размер зёрен (в) ‒ б);
3) размер зёрен (в)
|
Скорость роста кристаллов есть скорость увеличения линейных размеров растущего кристалла в единицу времени (мм/с).
Размер образующихся кристаллов определяется соотношением скоростей возникновения центров кристаллизации и их роста.
При малой степени переохлаждения число зародышей крайне мало, что приводит к образованию крупнокристаллической структуры. Кроме того, вследствие малой скорости роста кристаллов на их границах скапливаются легкоплавкие и вредные примеси — газы, окислы и шлаковые включения. С увеличением степени переохлаждения скорость роста кристаллов почти не изменяется, а число центров кристаллизации растет, что приводит к образованию мелкозернистой структуры. Увеличение степени переохлаждения достигается при заливке металла в металлические формы. Для регулирования размеров и формы зерен вводят в расплавленный металл вещества (различных примесей-кристалликов окиси алюминия, шлаковые включения, частицы футеровки и т. д.), создающих множество центров кристаллизации.Этот процесс называют модифицированием, а вводимые вещества — модификаторами.
1/6
Дата публикования: 2014-11-04; Прочитано: 7090 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
