 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
ВВЕДЕНИЕ 12 страница. ґ) у результаті виходу ферментів із загиблих пухлинних клітин у кров розвивається ферментемія;
|
|
ґ) у результаті виходу ферментів із загиблих пухлинних клітин у кров розвивається ферментемія;
д) при локалізації пухлини у травному каналі порушуються функції травної системи.
II. Загальні прояви, пов'язані з місцевими змінами тканин. До цієї групи відносять утворення виразок, вторинні інфекції, кровотечі, больовий синдром.
III. Паранеонластичні синдроми. Вони часто супроводжують розвиток пухлин, однак їх патогенез і зв'язок зі злоякісним пухлинним ростом залишаються нез'ясованими.
До цієї групи відносять:
а) ендокринопатії;
б) гіперкальціємію;
в) нервово-м'язовий синдром (міастенію, порушення центральної й периферичної нервової системи);
г) дерматологічні порушення; ґ) ураження кісток і суглобів;
д) судинні й гематологічні порушення (тромбози, анемію, лейкемоїдну реакцію).
Великий внесок у вивчення складних механізмів впливу пухлини на організм зробив Р. Є. Кавецький- учень
0. О. Богомольця.
16.43. Які фактори організму впливають на розвиток злоякісних пухлин?
Розвиток пухлини визначається не тільки властивостями самих пухлинних клітин, але й впливом організму на цей процес. Найбільше значення мають:
а) васкулярілзація пухлини. Показано, що максимальна віддаленість пухлинних клітин від просвіту кровоносних судин не може бути більше 1—2 мм. Якщо відстань перевищує цю величину, клітини пухлини гинуть.
У злоякісну пухлину, як правило, інтенсивно проростають кровоносні судини. Це пов'язане з тим, що пухлинні клітини вивільнюють так званий ангіогенетичний фактор (ангіогенін), що стимулює ріст капілярів і розмноження ендотеліальних клітин;
б) гормони. Хоча пухлинний процес є автономним, існують, однак, пухлини, які виявляють високу чутливість до гормонів. Це, зокрема, рак молочної залози, матки, яєчників, передміхурової залози. Одні гормони посилюють ріст зазначених пухлин, інші, навпаки, гальмують;
в) стан механізмів протипухлинного захисту організму.
16.44. Які механізми протипухлинного захисту існують в організмі?
1. Механізми природної неспецифічної резистентності організму до пухлин. Не мають імунологічної специфічності і не вимагають попередньої імунізації. Вони здійснюються такими клітинами:
а) NK-wiimuHOMU (природними кілерами). Це великі гранулярні лімфоцити, що є різновидом О-лімфоцитів. Вони розпізнають пухлинні клітини і знищують їх;
б) LAK-wiimuHaMU (лімфокін-активованими кілерами). Вони, як і NK-клітини, здійснюють цитоліз пухлинних клітин;
в) макрофагами. Знищення клітин пухлини макрофагами здійснюється за допомогою фагоцитозу й механізмів позаклітинної цитотоксичності. Механізми природного неспецифічного протипухлинного захисту ефективні, якщо кількість пухлинних клітин в організмі не перевищує 103.
II. Реакції набутого (специфічного) протипухлинного імунітету. Обумовлені специфічними пухлинними антигенами і складаються як з клітинних, пов'язаних з функцією Т-лімфоцитів, так і гуморальних, пов'язаних з утворенням антитіл, імунних реакцій.
Зазначені реакції ефективні, якщо кількість клітин у пухлині становить від 103 до 10б. Якщо ж їхня кількість перевищує 106, то розвивається стан імунологічної депресії й описані вище механізми протипухлинного захисту пригнічуються.
16.45. Назвіть основні патогенетичні підходи до лікування пухлин.
1. Хірургічне видалення.
2. Променева терапія (використання радіоактивного опромінення).
3. Хіміотерапія.
4. Імунотерапія.
5. Підвищення неспецифічної резистентності (наприклад, введення БЦЖ).
17. Порушення енергетичного обміну
17.1. Що таке позаклітинні і внутрішньоклітинні порушення енергетичного обміну?
Залежно від причин розвитку розрізняють поза- і внутрішньоклітинні розлади енергетичного обміну.
Позаклітинними називають розлади енергетичного обміну, пов'язані з первинними порушеннями забезпечення клітин поживними речовинами і киснем. Це голодування і більшість видів гіпоксії.
При внутрішньоклітинних розладах енергетичного обміну доставка поживних речовин і кисню не страждає, а порушується їх використання клітинами.
7 7.2. Назвіть основні причини порушення постачання клітин поживними речовинами.
1. Повна відсутність їжі або дефіцит поживних речовин у ній.
2. Порушення процесів травлення і всмоктування.
3. Порушення мобілізації поживних речовин з депо (наприклад, ураження печінки, розлади нервово-гуморальної регуляції жирового обміну).
4. Порушення транспорту поживних речовин кров'ю (загальні й місцеві розлади кровообігу).
5. Порушення дифузії поживних речовин у тканинах.
6. Втрата поживних речовин або їх використання не за призначенням (протеїнурія, глюкозурія, опікова хвороба, злоякісні пухлини).
17.3. Які порушення хімічного складу крові свідчать про порушення постачання клітин поживними речовинами?
1. Гіпоглікемія - зменшення концентрації глюкози в крові.
2. Гіполіпацидемія й гіполіпопротеїнемія — зменшення вмісту в крові вільних жирових кислот і ліпопротеїнів.
3. Гіпопротеїнемія й гіпоаміноацидемія - зменшення вмісту білків і вільних амінокислот у крові.
17.4. Назвіть причини внутрішньоклітинних порушень енергетичного обміну.
1. Порушення транспорту поживних речовин через клітинну мембрану (наприклад, глюкози при цукровому діабеті).
2. Порушення центральних внутрішньоклітинних катаболічних шляхів.
3. Розлади процесів біологічного окиснення в мітохондріях.
4. Роз'єднання процесів окиснення й фосфорування.
5. Порушення транспорту АТФ із мітохондрій до місць використання.
6. Порушення використання енергії АТФ.
17.5. Порушення яких центральних внутрішньоклітинних катаболічних шляхів можуть призводити до розладів енергозабезпечення клітин?
1. Пригнічення гліколізу.
2. Порушення циклу Кребса.
3. Розлади пентозного циклу.
4. Пригнічення окиснення жирових кислот.
5. Пригнічення процесів дезамінування і окиснення амінокислот.
17.6. Назвіть основні причини порушень центральних катаболічних шляхів у клітинах.
I. Зменшення вмісту вітамінів і вітаміноподібних речовин у клітинах (вітамінна недостатність).
II. Набуте зменшення активності ферментів:
а) зменшення активності окремих молекул ферментів (дія метаболічних отрут);
б) зменшення кількості молекул ферментів (розлади білоксинтетичної функції клітин).
III. Спадково обумовлені ензимопатії. Описано численні генетичні дефекти ферментів гліколізу, пентозного циклу, катаболічних перетворень амінокислот. Нині не відомі які-небудь ензимопатії, безпосередньо пов'язані з циклом Кребса й (3-окис-ненням жирових кислот.
IV. Дефіцит АТФ. АТФ використовується клітиною для активації субстратів, які надходять у центральні катаболічні шляхи (наприклад, фосфорування глюкози й фрук-тозо-6-фосфату, активація жирових кислот). Дефіцит АТФ створює "зачароване коло" — він порушує катаболічні перетворення поживних речовин, що веде до порушення ресинтезу АТФ. Це, у свою чергу, збільшує дефіцит макроергічних сполук.
17.7. Які причини можуть викликати розвиток вітамінної недостатності у клітинах?
Розвиток вітамінної недостатності в клітинах викликають:
а) гіпо- і авітамінози;
б) порушення транспорту вітамінів у клітину;
в) порушення перетворення вітамінів у коферменти;
г) порушення утворення холоферментів — комплексів коферментів з апоферментами.
17.8. Назвіть основні причини порушення біологічного окиснення в мітохондріях клітин.
1. Дефіцит коферментів: НАД, ФМН, убіхінону.
2. Дефіцит мікроелементів: Fe (входить до складу залізо-сірчаних центрів НАДН-дегі-дрогеназного комплексу і цитохромів) і Си (входить до складу цитохромоксидази).
3. Блокада транспорту електронів по дихальному ланцюгу (дія отрут— ротенону, антиміцину А, аміталу, ціанідів, оксиду вуглецю (II), сірководню; рис. 58).

Рис. 58. Блокада транспорту електронів по дихальному ланцюгу
4. Порушення акцепторного контролю дихання (АДФ не контролює швидкість транспорту електронів по дихальному ланцюгу).
17.9. Що таке роз 'єднання окиснення й фосфорування? Які його механізми?
Роз'єднання окиснення й фосфорування — це стан, при якому енергія, що вивільняється в процесі транспорту електронів по дихальному ланцюгу, не здатна акумулюватися в макроергічних зв'язках АТФ і тому виділяється у вигляді теплоти.
Для цього стану характерне зменшення ресинтезу АТФ і збільшення споживання кисню клітинами.
В основі роз'єднання окиснення й фосфорування можуть лежати такі механізми:
а) зменшення градієнта концентрацій іонів водню між матриксом мітохондрій і цитоплазмою;
б) зменшення трансмембранного електричного потенціалу на внутрішній мітохон-дріальній мембрані;
в) порушення АТФ-синтетазного ферментного комплексу;
г) використання енергії градієнта концентрацій іонів водню не на синтез АТФ, а на інші цілі (транспорт іонів кальцію із цитоплазми в мітохондрії, транспорт фосфату, АДФ, АТФ та ін.).
17.10. При порушенні яких біохімічних реакцій зменшується ресинтез АТФ у клітинах?
Утворення АТФ у клітинах зменшується за умов пригнічення: а) гліколітичного (субстратного) фосфорування:
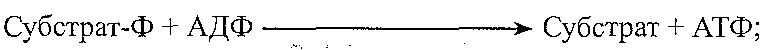
б) окисного фосфорування в мітохондріях:

в) креатинкіназної реакції:

г) аденілаткіназної реакції:

ґ) нуклеозиддифосфокіназної реакції:

17.11. Які наслідки для клітини має дефіцит АТФ?
Дефіцит АТФ у клітині призводить до:
1. Порушення механічної роботи - скорочення контрактильних структур клітин. Це виявляє себе розладами елементарних клітинних функцій: скорочення, міграції, екзо- і ендоцитозу, клітинного поділу, руху війок, джгутиків (рис. 59).
2. Порушення осмотичної роботи — процесів активного транспорту іонів. При дефіциті АТФ страждають механізми як первинного, так і вторинного активного транспорту: натрій-калієвий і кальцієвий насоси, натрій-кальцієвий і натрій-водневий обмінні механізми. Це викликає порушення внутрішньоклітинного гомеостазу й ушкодження клітин.
3. Порушення хімічної роботи — біосинтезу речовин. Наслідком цього є порушення самовідновлення й самовідтворення клітин, механізмів їх довгострокової адаптації до дії факторів навколишнього середовища. В остаточному підсумку відбувається повільна загибель клітин.
4. Порушення реакцій клітинного метаболізму.

Рис. 59. Шляхи використання АТФ у клітинах
17.12. Які порушення метаболізму в клітинах можуть бути пов'язані з первинним дефіцитом АТФ?
В умовах дефіциту АТФ порушуються не тільки реакції біосинтезу речовин (анаболізм), але й реакції їх розщеплення (катаболізм).
Це пов'язано з тим, що при дефіциті АТФ безпосередньо порушуються:
а) активація субстратів (фосфорування) і залучення їх у катаболічні шляхи (гліколіз, Р-окиснення);
б) активація багатьох ферментів, здійснювана протешкіназами;
в) утворення циклічного АМФ.
17.13. Наведіть приклади "зачарованих кіл" у розвитку енергодефіцитного стану клітин.
Зменшення вмісту АТФ у клітині призводить до пригнічення функції Са-насосів, внаслідок чого збільшується концентрація іонів кальцію в цитоплазмі. Це викликає роз'єднання окиснення й фосфорування - у результаті дефіцит АТФ зростає (див. розд. 11).
Недостатність АТФ у клітині є причиною порушень її білоксинтетичних функцій. Страждає синтез усіх білків, у тому числі й білків-ферментів. Це веде до порушення катаболічних перетворень поживних речовин у клітині й процесів біологічного окиснення - дефіцит АТФ збільшується (рис. 60).

Рис. 60. Одне з "зачарованих кіл" у розвитку енергодефіцитного стану клітини
17.14. Що таке основний обмін?
Основний обмін — це мінімальні енергетичні витрати організму, визначені ранком у стані повного спокою, натще (через 12-14 год. після останнього прийому їжі), в умовах температурного комфорту (t = 18-20 °С, вологість повітря - 60-80 %, швидкість його руху - 0,1-0,2 м/с).
17.15. Які зовнішні і внутрішні фактори впливають на величину основного обміну?
Зовнішні фактори:
а) кліматичні умови;
б) час доби;
в) висота над рівнем моря;
г) характер харчування; ґ) характер виробничої діяльності.
Внутрішні фактори:
а) ріст і маса тіла;
б) площа поверхні тіла;
в) вік;
г) стать.
17.16. Наведіть приклади збільшення і зменшення основного обміну в умовах патології.
Збільшення основного обміну характерне для гіперфункції щитоподібної залози, аденогіпофіза, статевих залоз.
Зменшення основного обміну реєструють при гіпофункції щитоподібної залози, аденогіпофіза, статевих залоз; при хронічній недостатності кори надниркових залоз, при голодуванні.
18с Голодування
18.1. Дайте визначення поняття "голодування".
Голодування - це типовий патологічний процес, що виникає внаслідок повної відсутності їжі або недостатнього надходження в організм поживних речовин, а також в умовах різкого порушення складу їжі та її засвоєння.
-J v-, •'
18.2. Як класифікують голодування?
За походженням виділяють фізіологічне, патологічне і лікувальне голодування. Фізіологічне голодування характерне для деяких видів тварин під час зимової (бабаки, ховрашки) або літньої сплячки (плазуни).
Залежно від змісту виділяють такі види голодування.
1. Повне голодування:
а) із уживанням води;
б) без уживання води (абсолютне).
2. Неповне голодування (недоїдання).
3. Часткове голодування (якісне).
18.3. На які періоди поділяють патогенез повного голодування із уживанням води?
I. Період неекономного витрачання енергії.
II. Період максимального пристосування.
III. Термінальний період.
18.4. Чим характеризується період неекономного витрачання енергії?
Його тривалість— 2-4 доби. Характерне сильне відчуття голоду, обумовлене збудженням харчового центру. При повному голодуванні воно триває до 5-ти діб, а потім зникає. Відбувається швидке падіння маси тіла (схуднення). Основним джерелом енергії у цей період є вуглеводи, про що свідчить дихальний коефіцієнт, який дорівнює 1,0. Виникає гіпоглікемія, яка збільшує секрецію глюкокортикоїдів корою надниркових залоз. Наслідком цього є посилення катаболізму білків у периферичних тканинах, зокрема м'язовій, і активація глюконеогенезу в печінці.
Основний обмін спочатку трохи збільшується, а потім поступово зменшується і стає на 10—20 % менше вихідного. Розвивається негативний азотистий баланс.
18.5. Що характерно для другого періоду голодування - періоду максимального пристосування?
Середня його тривалість — 40-50 діб. Темпи зменшення маси тіла уповільнюються і становлять 0,5-1 % на добу. Відчуття голоду зникає. Основним джерелом енергії є жири, про що свідчить дихальний коефіцієнт, який дорівнює 0,7.
Гіпоглікемія збільшує надходження в кров ліполітичних гормонів (адреналіну, глюкокортикоїдів, глюкагону). Унаслідок цього відбувається мобілізація жиру з депо — розвивається гіперліпацидемія. Вона, у свою чергу, є причиною посиленого утворення кетонових тіл у печінці. Кетонемія, що виникає, може призводити до не-газового ацидозу.
Основний обмін у цей період на 10-20 % нижче вихідного рівня. Азотистий баланс негативний.
18.6. Як втрачають масу різні органи і тканини в другому періоді голодування?
Втрата маси в другому періоді голодування становить: жирова тканина — 97 %,' селезінка — 60 %, печінка — 54 %, сім'яники — 40 %, м'язи - 31 %, кров - 26 %, нирки - 26 %, нервова система - 4 %, серце - 3,6 %.
18.7. Дайте характеристику третього періоду голодування.
Цей період називають термінальним, тому що він передує смерті. Його тривалість 2—3 доби. Відбувається інтенсивний розпад тканин, розвивається інтоксикація. Основним джерелом енергії є білки, про що свідчить дихальний коефіцієнт, який дорівнює 0,8. Збільшується виділення із сечею азоту, калію, фосфатів (ознаки деструкції клітин і тканинних білків).
Смерть настає при зменшенні маси тіла до 50 % від вихідної.
18.8. Які фактори визначають максимально можливу тривалість повного голодування із уживанням води?
І. Ендогенні фактори:
а) вид тварини-
б) вік;
в) стать;
г) кількість і якість жирових та білкових резервів організму; ґ) загальний функціональний стан організму;
д) м'язова робота.
Усі зазначені чинники впливають на тривалість голодування, змінюючи величину основного обміну. Що вищий рівень основного обміну, то менша тривалість голодування, і навпаки. її. Екзогенні фактори. Це чинники зовнішнього середовища, які збільшують енер-говитрати організму. Такими є:
а) низька температура навколишнього середовища;
б) висока вологість повітря;
в) велика швидкість руху повітря.
18.9. Як розрахувати максимально можливу тривалість повного голодування із вживанням води?
Для такого розрахунку слід пам'ятати, що, по-перше, дорослий організм гине при втраті 50 % вихідної маси тіла й, по-друге, втрата маси в другому, самому тривалому періоді голодування становить 0,5—1 % на добу.
Так, якщо вихідна маса тіла дорівнює 70 кг, то смерть настає при втраті 35 кг. За умови, що кожної доби втрачається 0,5 % вихідної маси (0,35 кг), максимально можлива тривалість другого періоду, а отже й голодування в цілому, становить 100 днів.
18.10. Що таке абсолютне голодування? У чому його особливість?
Абсолютним називають повне голодування без уживання води. Його тривалість у 2-3 рази менша, ніж тривалість повного голодування з водою.
При абсолютному голодуванні відбувається посилене розщеплення жирів для утворення ендогенної (оксидаційної) води, у результаті чого швидко розвивається кетонемія і негазовш ацидоз. Важкість протікання абсолютного голодування обумовлена також накопиченням великої кількості кінцевих продуктів обміну й інших токсичних продуктів, для виведення яких з організму потрібна вода.
18.11. Назвіть особливості неповного голодування.
Неповне голодування (енергетична недостатність) розвивається, коли енергетична цінність їжі не задовольняє енергетичні потреби організму.
Неповне голодування від повного відрізняється такими особливостями:
1) тривалістю (неповне голодування може тривати місяці, роки);
2) більш вираженими деструктивними змінами в тканинах;
3) значно більшим зменшення основного обміну (на 30—40 %);
4) розвитком виражених набряків унаслідок зменшення вмісту білків у плазмі крові;
5) великого падіння маси тіла не відбувається через затримку рідини в організмі;
6) відновити життєдіяльність систем організму після неповного голодування набагато складніше.
18.12. Що таке білково-енергетична недостатність? Наведіть приклади.
Білково-енергетична недостатність — це стан, що виникає як результат поєднання неповного і якісного білкового голодування. Прикладами є:
а) аліментарна дистрофія. Описана в Ленінграді під час облоги в роки другої світової війни. У її патогенезі, крім білкової й енергетичної недостатності, мають значення й додаткові чинники: холод, фізичне стомлення, нервово-психічна напруга;
б) аліментарний маразм. Розвивається в дітей віком до одного року. На перше місце виступає енергетична недостатність;
в) квашіоркор. Розвивається в дітей віком 3-6 років. Головним у патогенезі є білкова недостатність. Енергетичний дефіцит компенсується надлишковим споживанням вуглеводів.
18.13. Якими клінічними синдромами виявляє себе білково-енергетична недостатність?
І. Недостатнє надходження в організм білків призводить до порушення білоксин-тетичної функції печінки. Це є причиною гіпопротеїнемії, що, у свою чергу, обумовлює розвиток онкотичних набряків.
II. Енергетична недостатність є причиною зменшення основного обміну. Це виявляється зниженням температури тіла (гіпотермією).
III. Атрофічні синдроми. їх розвиток пов'язаний з порушеннями пластичного й енергетичного забезпечення клітин.
18.14. Якими порушеннями фізіологічних функцій виявляють себе атрофічні зміни в органах і тканинах при білково-енергетичній недостатності?
Атрофічні зміни розвиваються у всіх тканинах, органах і системах організму.
Проявом атрофічних змін у ЦНС є уповільнення розумового розвитку, у травній системі - розлади всмоктування і діарея, у серцево-судинній системі — гіпотензія, в імунній системі — зменшення синтезу антитіл і підвищення чутливості до інфекцій, у червоному кістковому мозку — розвиток анемії, у скелетних м'язах — гіподинамія та м'язова слабкість, у кістках — затримка росту скелета.
18.15. Що таке часткове (якісне) голодування? Назвіть його види.
Частковим (якісним) голодуванням називають недостатнє надходження з їжею одної або кількох поживних речовин при нормальній енергетичній цінності їжі.
Видами часткового голодування є білкове, жирове, вуглеводне, вітамінне, мінеральне, водне голодування.
19о Гіпоксія
19.1. Дайте визначення поняття "гіпоксія".
Гіпоксія (кисневе голодування) — це типовий патологічний процес, що виникає внаслідок недостатнього постачання тканин киснем або в результаті порушення його використання клітинами.'
19.2. Як класифікують кисневе голодування?
I. Етіологічна класифікація:
а) гіпоксична (екзогенна);
б) дихальна (респіраторна);
в) серцево-судинна (циркуляторна);
г) кров'яна (гемічна); ґ) тканинна (гістотоксична) гіпоксія.
II. За темпами розвитку і тривалістю виділяють:
а) блискавичну;
б) гостру;
в) підгостру;
г) хронічну гіпоксію Ні. Залежно від поширеності процесу гіпоксія може бути загальною і місцевою.
19.3. У яких біохімічних процесах, що відбуваються в організмі, використовується кисень?
I. Тканинне (клітинне) дихання. Здійснюється в мітохондріях клітин за участю дегідрогеназ та інших компонентів дихального ланцюга, що забезпечують транспорт електронів від субстрату на кисень. Основна функція клітинного дихання - вивільнення енергії поживних речовин і акумулювання її в макроергічних зв'язках АТФ (окисне фосфорування).
На ці процеси клітинами використовується не менше 90 % кисню, що поглинається.
II. Мікросомне окиснення. Здійснюється в ендоплазматичному ретикулумі клітин. Особливо інтенсивно проходить у печінці та деяких ендокринних залозах (надниркових, статевих).
Каталізаторами мікросомного окиснення є ферменти оксигенази, які приєднують кисень безпосередньо до субстрату. Залежно від кількості атомів кисню, який приєднується, розрізняють монооксигенази і діоксигенази. Перші забезпечують реакції гідроксилювання (утворення стероїдних гормонів, перетворення проліну в оксипролін), другі - реакції детоксикації в печінці.
III. Пероксидгенеруючі реакції. Здійснюються в пероксисомах, а також у гранулах нейтрофілів і макрофагів. їхніми каталізаторами є ферменти оксидази, що забез-
печують утворення пдропероксидш цілого ряду сполук і пероксиду водню. Зазначені процеси мають значення в катаболізмі деяких сполук (амінокислот, пуринів), а в лейкоцитах є одним з механізмів бактерицидності. IV. Пероксидне окиснсння ліпідів (див. розд. 11). У нормі інтенсивність цього процесу незначна. Він істотно активується при ушкодженні клітин.
19.4. Які механізми можуть лежати в основі зменшення напруги кисню в тканинах?
1. Зменшення доставки кисню кров'ю.
2. Порушення дифузії кисню від кровоносних капілярів до клітин.
3. Посилене використання кисню клітинами.
19.5. Назвіть причини зменшення доставки кисню кров'ю.

де С. — вміст кисню в артеріальній крові; Q — об'ємна швидкість течії крові. Причинами порушення доставки кисню кров'ю можуть бути:
а) зменшення вмісту кисню в артеріальній крові;
б) зменшення об'ємної швидкості течії крові в тканині (порушення кровопостачання);
в) зменшення віддачі кисню гемоглобіном (зменшення дисоціації оксигемоглобіну).
19.6. Чим може бути обумовлене зменшення вмісту кисню в артеріальній крові?

де - Ск - вміст кисню в артеріальній крові; [НЬ] - концентрація гемоглобіну в крові; S — насичення гемоглобіну киснем; 1,34 - число Хюфнера.
Причиною зменшення вмісту кисню в артеріальній крові можуть бути:
а) зменшення концентрації гемоглобіну, здатного зв'язувати кисень (зменшення кисневої ємності крові). Це може бути обумовлено або анемією (зменшується загальний вміст гемоглобіну), або інактивацією гемоглобіну;
б) зменшення насичення гемоглобіну киснем. Закономірно виникає при зменшенні напруги кисню в артеріальній крові нижче 60 мм рт. ст.
19.7. Які зміни можуть зменшувати об'ємну швидкість течії крові в тканинах і призводити до гіпоксії?
Оскільки
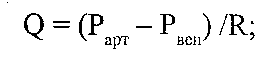
де Q — об'ємна швидкість течії крові; Ра — артеріальний тиск на початку, а Рвсн — венозний тиск наприкінці перфузованої ділянки; (Р т — Р) перфузійний тиск; R — гемодинамічний опір, то зменшення кровопостачання тканин може бути обумовлене такими групами причин.
І. Зменшення перфузійного тиску в судинах органа або тканини:
а) зменшення артеріального тиску;
б) збільшення венозного тиску.
IJ. Збільшення гемодинамічного опору судин даної ділянки:
а) звуження судин;
б) підвищення в'язкості крові.
19.8. Які фактори викликають зміщення кривої дисоціації оксигемоглобіну?
Крива дисоціації оксигемоглобіну відображує залежність між напругою кисню в артеріальній крові і насиченням гемоглобіну киснем (рис. 61).
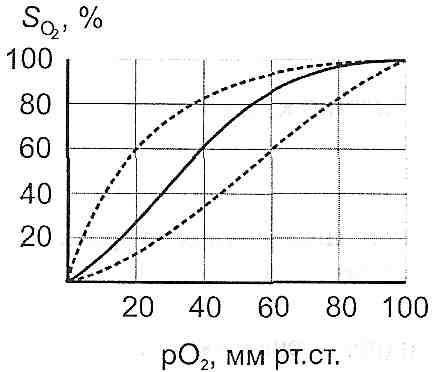
Рис. 61. Крива дисоціації оксигемоглобіну
Зміщення цієї кривої вліво відбувається при:
а) зниженні температури;
б) алкалозі;
в) гіпокапнії;
г) зменшенні в еритроцитах вмісту 2,3-дифос- -фогліцерату;
ґ) отруєннях оксидом вуглецю (II);
д) появі спадково обумовлених патологічних форм гемоглобіну, які не віддають кисень тканинам.
При зміщенні кривої вліво гемоглобін легше приєднує кисень у капілярах легень, але гірше віддає його тканинам.
Причиною зміщення кривої дисоціації оксигемоглобіну вправо можуть бути:
а) підвищення температури;
б) ацидоз;
в) гіперкапнія;
г) збільшення вмісту в еритроцитах 2,3-дифосфогліцерату.
Вплив ацидозу і гіперкапнії на дисоціацію оксигемоглобіну відомий як ефект Бора.
При зміщенні кривої вправо гемоглобін гірше приєднує кисень у капілярах легень, але краще віддає його тканинам. З цим, зокрема, пов'язане захисно-компенсаторне значення ефекту Бора при кисневому голодуванні.
19.9. Які фактори зумовлюють порушення дифузії кисню в тканинах? Відповідно до закону Фіка

де m — кількість газу, що дифундує (дифузійний потік); k — коефіцієнт дифузії; S - загальна площа поверхні, через яку здійснюється дифузія; 1 - відстань дифузії; (Pj —Р2) — різниця між напругою О, у капілярах і клітинах.
Звідси випливає, що причинами порушення дифузії кисню в тканинах можуть бути:
1) зменшення коефіцієнта дифузії кисню (наприклад, при відкладеннях у тканині ліпідів, гіаліну, амілоїду, солей кальцію);
2) зменшення загальної площі поверхні кровоносних капілярів при зменшенні їхньої кількості;
Дата публикования: 2014-11-04; Прочитано: 1392 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
