 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Аминокислотный состав белков
|
|
С химической точки зрения белки - это высокомолекулярные азотсодержащие органические соединения (полиамиды), молекулы которых построены из остатков аминокислот. Мономерами белков служат α-аминокислоты, общим признаком которых является наличие карбоксильной группы -СООН и аминогруппы -NH2 у второго углеродного атома (α-углеродный атом):

Аминокислоты классифицируют: - по полярности радикалов на полярные (гидрофильные) и неполярные (гидрофобные);
- по природе радикалов на алифатические (глицин, аланин, валин, лейцин, изолейцин); гидроксиаминокислоты (серии, треонин); дикарбоновые, кислые, (аспарагиновая, глутаминовая и их амиды - аспарагин и глутамин); тиоаминокислоты (цистеин, метионин); диаминомонокарбоновые, щелочные (лизин, аргинин); ароматические (фенилаланин, тирозин); гетероциклические (триптофан, гистидин, пролин).
В настоящее время известно более 200 аминокислот, существующих в природе. В организме человека содержится около 60 различных аминокислот и их производных. В белках же всех видов живых существ - от бактерий до человека - обнаруживают менее 30 из них.
Эти аминокислоты делят на две группы: постоянно встречающиеся в белках (главные) и иногда встречающиеся (редкие). К первой группе относят 20 аминокислот (в том числе и пролин, который, по существу, является иминокислотой) (табл.4).
Таблица 4. Аминокислоты, постоянно встречающиеся в составе белков
| № п/п | Название | Структура | Сокращенное обозначение русское, латинское | pI |
| I. Неполярные(гидрофобные) аминокислоты | ||||
| 1. | Аланин | 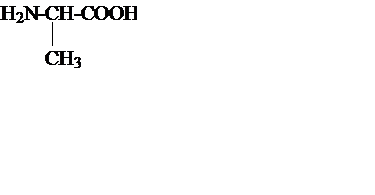
| Ала, Ala | 6,02 |
| 2. | Валин | 
| Вал, Val | 5,97 |
| 3. | Лейцин | 
| Лей, Leu | 5,98 |
| 4. | Изолейцин | 
| Иле, Ile | 6,02 |
| 5. | Триптофан | 
| Три, Try | 5,88 |
| 6. | Пролин (иминокислота) | 
| Про, Pro | 6,10 |
| 7. | Фенилаланин | 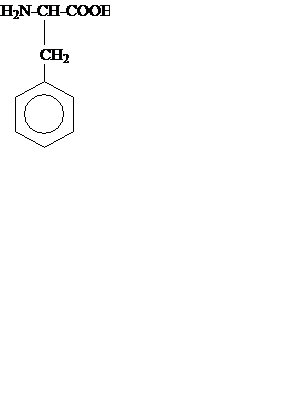
| Фен, Phe | 5,98 |
| 8. | Метионин | 
| Meт, Met | 5,75 |
| II. Полярные (гидрофильные) незаряженные аминокислоты | ||||
| 9. | Глицин | 
| Гли, Gly | 5,97 |
| 10. | Серин | 
| Сер, Ser | 5,68 |
| 11. | Треонин | 
| Тре, Thr | 6,53 |
| 12. | Цистеин | 
| Цис, Cys | 5,02 |
| 13. | Тирозин | 
| Тир, Tyr | 5,65 |
| 14. | Аспарагин | 
| Асн, Asn | 5,41 |
| 15. | Глутамин | 
| Гли,Gln | 5,65 |
| III. Отрицательно заряженные (кислые) аминокислоты | ||||
| 16. | Аспарагиновая кислота (Аспартат) | 
| Асп, Asp | 2,95 |
| 17. | Глутаминовая кислота (Глутамат) | 
| Глу, Glu | 3,22 |
| IV. Положительно заряженные (основные) аминокислоты | ||||
| 18. | Лизин | 
| Лиз, Lys | 9,74 |
| 19. | Аргинин | 
| Арг, Arg | 10,76 |
| 20. | Гистидин | 
| Гис, His | 7,58 |
К группе редко встречающихся аминокислот принадлежат, например, гидроксипролин, гидроксилизин, орнитин, йодтирозин, α-аминоизомасляная кислота и некоторые другие. Они имеют следующее строение:

| 
| 
| |
| α-аминоизомасляная кислота | гидроксипролин | орнитин | |

| 
| ||
| йодтирозин | гидроксилизин | ||
Эти аминокислоты образуются из главных уже после включения их в состав белковой молекулы.
Дата публикования: 2015-11-01; Прочитано: 3413 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
