 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Складання рівнянь простих окисно-відновних реакцій, підбір коефіцієнтів. Поняття про метод електронного балансу
|
|
Існує універсальний і ефективний метод підбору коефіцієнтів в схемах окисно-відновних реакцій. Його назва - метод електронного балансу. Він заснований на тому, що число електронів, які віддають одні частки і приєднують інші, завжди однакове.
Підберемо коефіцієнти методом електронного балансу в схемі окислювально-відновної реакції:
 .
.
Спочатку визначимо міру окислення кожного елементу в реагентах і продуктах реакції і виділимо елементи, які змінили свої міри окислення:
 .
.
Ви бачите, що Ферум підвищив ступінь окислення від +2 до +3, виступив відновником і окислився, а Оксиген знизив ступінь окислення від 0 до -2, виконав функцію окислювача і відновився:
| схема окислення Феруму | схема відновлення Оксигену |

| 
|
Зверніть увагу! у схемі відновлення перед атомом Оксигену поставлений коефіцієнт 2, оскільки з однієї молекули кисню утворюються два атоми. Вказано також, що молекула кисню приєднує 4 електрони, оскільки кожен атом Оксигену в ній приєднує 2 електрони.
Знаходимо співвідношення часток окислювача і відновника, при якому число електронів,що приєднуються і число електронів, що віддаються ними, буде однаковим. Для цього визначаємо найменше спільне кратне чисел 1 (один електрон втрачає атом  ) і 4 (чотири електрони приєднує молекула
) і 4 (чотири електрони приєднує молекула  ); воно дорівнює 4.
); воно дорівнює 4.
Записуємо схему окислення, під нею - схему відновлення, а після вертикальних ліній - тільки що вказані кількості електронів і найменше загальне кратне:
 процес окислення
процес окислення
 процес відновлення
процес відновлення
Розділивши число 4 на кількість електронів, які втрачаються (1) і приєднуються (4), отримуємо числа 4 і 1 для схем окислення і відновлення відповідно. Записуємо їх за третьою вертикальною лінією:
 процес окислення
процес окислення
 процес відновлення
процес відновлення
Числа в останньому стовпчику - 4 і 1- це коефіцієнти в майбутньому рівнянні.
Насправді, кожні 4 атоми  втрачають 1х4 = 4 електрони, і стільки ж електронів приєднує кожна молекула
втрачають 1х4 = 4 електрони, і стільки ж електронів приєднує кожна молекула  .
.
Записуємо коефіцієнти 4 перед формулами сполук Феруму, а коефіцієнт 1 перед формулою кисню не вказуємо:

Далі ставимо коефіцієнт 2 перед формулою води:

Нарешті, визначений коефіцієнт перед формулою хлороводню - сполука, у якій містяться елементи, ступені окислення, яких не змінилися, і замість стрілки записуємо знак рівності:
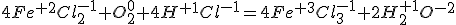 .
.
Перевірте, чи однакова кількість атомів кожного елементу міститься в лівій і правій частинах складеного рівняння.
Вправа. Розставте коефіцієнти в рівняннях реакцій методом електронного балансу, укажіть окисник та відновник:
1) C + HNO3 → CO2 + NO2 + H2O
2) C + H2SO4 → CO2 + SO2 + H2O
3) P + HNO3 + H2 O → H3 PO4 + NO
4) Mg + H2 SO4 → Mg SO4 + H2 S + H2 O
5) Ag + HNO3 → AgNO3 + NO2 + H2O
6) Zn + H2SO4 → ZnSO4 + S + H2O
7) Cu + H2SO4 → CuSO4 + SO2 + H2O
8) Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
9) Cu + HNO3 → Cu(NO3)2 + NO + H2O
10) S + KOH → K2SO3 + K2S + H2O
11) MnO2 + HCl → MnCl2 + Cl2 + H2O
12) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
13) Cl2 + H2S + H2O → HCl + H2SO4
14) K2SO3 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O
15) Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
16) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
17) K2Cr2O7 + H2S + H2SO4 → Cr2(SO4)3 + S + K2SO4 + H2O
18) KClO3 + S → SO2 + KCl
19) Zn + HNO3 → Zn(NO3)2 + N2O + H2O
20) FeCl3 + H2S → FeCl2 + S + H2O
Вправа. Вкажіть визначення відновника:
- речовина, яка віддає електрони і при цьому окиснюється
- речовина, яка віддає електрони і при цьому відновлюється
- речовина, яка приймає електрони і при цьому відновлюється
- речовина, яка приймає електрони і при цьому окиснюється
Вправа. Виберіть рядок ступенів окиснення Нітрогену відповідно послідовності сполук NH3 , N2 O, NO2 , N2 O5 .
-3, +2, +4, +5
-3, +1, +2, +5
-3, +1, +4, +5
+3, +1, +4, +5
Вправа. Виберіть твердження щодо реакції
Fe + HCl →FeCl2 + H2
Дата публикования: 2015-11-01; Прочитано: 519 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
