 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ступінь електролітичної дисоціації. Сильні та слабкі електроліти
|
|
Кількісно процес дисоціації речовин у розчині можна оцінити за ступенем електролітичної дисоціації.
Ступінь електролітичної дисоціації – це відношення числа частинок речовини, що продисоціювали до загального числа частинок цієї речовини у розчині.
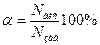
де α – ступінь електролітичної дисоціації;
Nдис. – число частинок речовини, що про дисоціювали;
Nзаг. – загальне число частинок речовини у розчині.
Залежно від значення ступеню електролітичної дисоціації електроліти поділяються на три види:
1. сильні електроліти (α > 30%). До них належать сильні кислоти (HCl, HBr, HNO3, H2SO4), луги та солі.
2. електроліти середньої сили (3% < α < 30%). Наприклад: H3PO4, HF.
3. слабкі електроліти (α < 3%). До них належать H2O, NH4OH, H2CO3, H2SO3, H2S, органічні кислоти та ін.)
Необхідно також враховувати, що такі слабкі електроліти як карбонатна кислота H2CO3, сульфітна кислота H2SO3, амоній гідроксид NH4OH є нестійкими сполуками, що розпадаються з утворенням води та газоподібної речовини.



Вправа. Обчисліть ступінь дисоціації електроліту, якщо відомо, що дисоціює у розчині молекул речовини:
а) 20 із 200;
б) 10 із 800;
в) 30 зі 100;
г) 50 зі 150;
д) 156 із 300.
В кожному випадку зазначте силу електроліту.
Дата публикования: 2015-11-01; Прочитано: 689 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
