 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Персонализированная медицина. Фармакогенетика. Фармакогеномика
|
|
Цель персонализированной медицины состоит в том, чтобы найти конкретное лекарство для конкретного больного, разработать схему лечения больного в соответствии с его генотипом и обосновать меры профилактики. В более широком смысле персонализированная медицина представляет собой интегральную медицину, которая включает разработку персонализированных средств лечения на основе геномики, тестирование на предрасположенность к болезням, профилактику, объединение диагностики с лечением и мониторинг лечения.
Термин «personalized medicine» впервые появился в качестве названия монографии, изданной Кеваль Джайн (Швейцария) в 1998 г. Наряду с понятием «персонализированная медицина» (personalized medicine), для обозначения индивидуализации лечения применяют и другие термины, в том числе «предсказательная медицина» (predictive medicine) и «геномная медицина» (genomic medicine). Еще до того как предметом внимания в медицине стала концепция персонализации, индивидуальный подход применялся, например, при переливании крови, трансплантации тканей и клеточной терапии. Типирование тканей на основе генетических маркеров применяется при подборе трансплантатов для конкретных реципиентов, а в некоторых способах лечения рака используются собственные опухолевые клетки пациента.
В настоящее время концепция персонализации распространяется на все фармацевтические препараты. Стало ясно, что реакция пациентов с одной и той же болезнью на одно и то же лекарство различается в зависимости от генотипа больного (генетической конституции организма), так что возможны значительные колебания в эффективности и безопасности препарата, применяемого для лечения определенного заболевания.
Индивидуализация лечения подразумевает также досимптоматическую идентификацию предрасположенности к той или иной болезни и выбор адекватных профилактических мер.
Важную часть основ персонализированной медицины составляют шесть технологий и подходов: (I) молекулярная диагностика, в особенности определение полиморфизма по единичным нуклеотидам (SNP), (II) интеграция диагностики и лечения, (III) мониторинг лечения, (IV) фармакогенетика, (V) фармакогеномика и (VI) фармакопротеомика. Первые три составляющие известны хорошо. Но существуют некоторые различия во мнениях о сути трех последних, которые можно определить следующим образом.
Фармакогенетика — это исследование влияния генетических факторов на действие лекарств; данный термин был принят в фармакологии еще в догеномную эру. Фармакогеномика — это применение геномики для разработки новых лекарств. Она включает исследование механизмов действия лекарств на клетки на основе изучения изменений экспрессии генов. Фармакопротеомика — это применение протеомики к разработке новых лекарств, её можно рассматривать как расширение фармакогеномики.
Концептуальную основу предиктивной медицины составляют представления о генетическом полиморфизме.
Генетический полиморфизм и гены предрасположенности. В отличие от мутаций, приводящих к патологическим изменениям и снижающих жизнеспособность, генетические полиморфизмы проявляются в фенотипе менее очевидно. Вместе с тем генетические полиморфизмы далеко не всегда являются нейтральными, значительно чаще они приводят к появлению белковых продуктов с несколько измененными физико-химическими свойствами и, соответственно, параметрами функциональной активности. Известно, что однонуклеотидные замены (SNP) в смысловых частях гена часто влияют на такие характеристики как изменение третичной структуры белка, стабильность его связывания с субстратом и промежуточными метаболитами, посттрансляционную модификацию, температурный оптимум активности и пр. Некоторые миссенс - мутации оказывают сильное влияние на гидрофобность белка, его водородные, электростатические и сульфгидрильные связи. При этом функциональный спектр таких белков может сильно меняться от практически нейтрального эффекта генетического полиморфизма до полного нарушения функции соответствующего белкового продукта.
В определенных условиях некоторые генетические полиморфизмы могут предрасполагать либо, наоборот, препятствовать проявлению различных заболеваний. Г ены предрасположенности — это мутантные гены (аллели), которые совместимы с рождением и жизнью в постнатальном периоде, но при определенных неблагоприятных условиях способствуют развитию того или иного заболевания.
В зависимости от особенностей действия и роли в метаболических процессах гены «предрасположенности» условно подразделяют на гены «внешней среды», гены - «триггеры» и гены клеточных рецепторов. Именно аллельные варианты этих генов составляют основу таких частых заболеваний как атеросклероз, ишемическая болезнь сердца (ИБС), остеопороз, диабет, бронхиальная астма, опухоли и пр. Сочетания аллельных вариантов различных генов, вовлеченных в развитие каждой конкретной патологии, получили название «генных сетей». В каждой из таких сетей выделяют главные (центральные) гены, и дополнительные (вспомогательные) гены, называемые также генами-модификаторами.
Составление генной сети для каждого мультифакториального заболевания, идентификация в ней центральных генов и генов-модификаторов, анализ ассоциации их полиморфизмов с конкретным заболеванием, разработка на этой основе комплекса профилактических мероприятий для конкретного пациента составляют основу предиктивной (предсказательной) медицины.
В настоящее время в клинической практике применяются около 150—200 генетических тестов и разработаны панели генетических тестов для многих наиболее частых мультифакториальных болезней.
Гены внешней среды (гены детоксикации). Гены детоксикации кодируют разнообразные ферменты, ответственные за метаболизм, деграда-цию, детоксикацию и выведение ксенобиотиков.
Именно эти гены, точнее их полиморфные варианты, определяют индивидуальные особенности реакции организма на различные химические препараты и пищевые продукты. Генетические полиморфизмы, приводящие к полному отсутствию соответствующего белка, либо к появлению ферментов с измененной, как правило, более низкой, чем в норме, активностью, и являются причиной выраженной индивидуальной вариабельности реакций организма на лекарственные препараты, промышленные загрязнения, гербициды и пр.
Большинство ксенобиотиков, попадая в организм, не оказывают прямого биологического эффекта, но подвергаются различным превращениям, так называемой биотрансформации, которая является трехэтапным процессом, включающим активацию (фаза 1), детоксикацию (фаза 2) и выведение (фаза 3) (рис.7). Гены, кодирующие ферменты биотрансформации, характеризуются значительным полиморфизмом и обнаруживают существенные популяционные, этнические и расовые вариации, связанные с исторически сложившимися традициями, различиями продуктов питания, географической среды обитания, эпидемиями и пр. Типичными представителями фазы 1 являются гены системы цитохромов, фазы 2 — гены семейства трансфераз. Некоторые из этих генов и их полиморфизмы приведены в табл. 1.
Высокая активность различных цитохромов (фаза 1) в сочетании с низкой или нормальной активностью ферментов фазы 2 является наиболее неблагоприятным вариантом, при этом риск развития заболевания или патологического состояния резко возрастает.
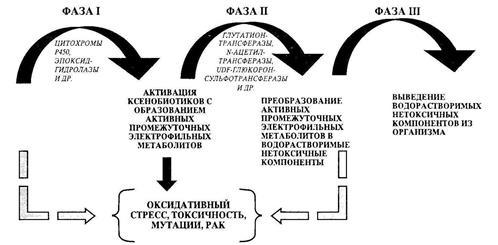
Рисунок 7-Основные фазы детоксикации [1]
Так, высокая активность ферментов фазы I детоксикации (CYP1A1, CYP1A2, CYP1 Bl, CYP3A4, CYP2A6) предрасполагает к раку легких (особенно у курящих индивидуумов), а также к раку мочевого пузыря и толстого кишечника. Повышенная активность CYP1A2 может быть индуцирована табачным дымом, пережаренным мясом, некоторыми лекарствами (полибромидные бифенилы), а также диоксином. При некоторых вирусных заболеваниях также происходит повышение активности этого цитохрома. Столь же пагубные последствия для здоровья могут иметь и патологические аллели генов эпоксидгидролаз (фаза 1). Так, отмечено, что лица, гомозиготные по «медленной» форме микросомальной эпоксидгидролазы (тЕРХН), составляющие до 6% населения России, обнаруживают высокую чувствительность к действию табачного дыма, различных оксидантов, ксенобиотиков с повышенной продукцией свободных радикалов. У них чаще, чем в популяции, встречаются заболевания легких, в том числе эмфизема, хронические обструктивные пневмонии, а при наличии мутаций в гене CFTR заболевание муковисцидозом протекает особенно неблагоприятно.
Неполноценный (нулевой) аллель глутатион-5-трансферазы (GSTM1), не случайно ассоциирован с раком легких, хроническим обструктивным бронхитом, раком мочевого пузыря и даже с таким частым мультифакториальным заболеванием как эндометриоз. На фоне алкоголизма у гомозигот GSTM10/0 чаще развивается цирроз печени. Имеются многочисленные данные о предрасположенности лиц, гомозиготных по «ослабленному» аллелю гена GSTP1 к различным опухолям, в том числе к раку кожи, а также к болезни Паркинсона.
Таблица 1 – Гены детоксикации
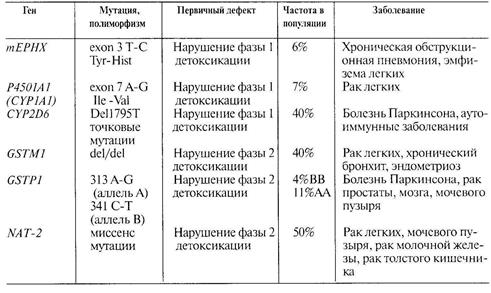
Генетический полиморфизм гена NAТ-2, ответственного за синтез фермента N-ацетилтрансферазы 2, может существенно влиять на возникновение рака молочной железы. Этот эффект находится в прямой зависимости от курения. У женщин, гомозиготных по медленному аллелю этого гена (медленные «ацетиляторы»), курение увеличивает почти в 20 раз риск развития рака молочной железы. В то же время у курящих женщин, относящихся к группе быстрых «ацетиляторов», такой закономерности не отмечается.
Таким образом, по крайней мере, некоторые аллели генов «внешней среды» ассоциированы, а возможно, и непосредственно вовлечены в возникновение ряда онкологических и иных заболеваний.
Гены мембранных рецепторов. Поступление ксенобиотиков в организм, равно как и всякие межклеточные взаимодействия регулируются рецепторным аппаратом клеточных мембран. Для многих генов рецепторных белков показано наличие полиморфизмов, а для некоторых доказано неблагоприятное фенотипическое проявление некоторых аллельных вариантов. В частности, функционально ослабленный аллель гена рецептора витамина D3 (VDR3) может предрасполагать к остеопорозу — заболеванию, возникающему при снижении минеральной плотности костей и приводящему к увеличению вероятности переломов. Аллели с низким числом CAG повторов в гене адренорецептора (AR) ассоциированы с раком предстательной железы. Тестирование мужчин по данному полиморфизму полезно для выявления лиц с генетической предрасположенностью к раку простаты задолго до начала заболевания, что позволяет более рационально организовать его профилактику.
Делеция 32-х нуклеотидов в гене CCR5, ответственном за синтез кофактора рецептора CD4 (рецептор CD4 служит основным входом для штаммов вируса ВИЧ-1 в клетки макрофагов и моноцитов), приводит к возникновению мутантного белка с несколько измененными функциями. Белок, несущий делецию, приводит к существенному затруднению проникновения патогенного вируса иммунодефицита человека в клетки у гетерозиготных носителей мутации, или полностью блокирует проникновение — у гомозиготных носителей делеции. Высокая частота (до 14%) этого аллеля в одних популяциях и крайне низкая — у других, может иметь существенное значение в плане организации рациональной профилактики пандемии СПИДа.
Гены-триггеры. К тяжелым мультифакториальным заболеваниям могут приводить мутации в генах, играющих ключевую роль в поддержании клеточного гомеостаза, которые названы генами- триггерами мультифакториальных болезней. Именно к этой группе отнесены многочисленные онкогены, а также гены онкосупрессоров (например, р53), следствием мутаций которых является активация соответствующих онкогенов и включение цепи метаболических реакций, приводящих, в конечном счете, к злокачественной трансформации клеток. Для многих десятков таких генов уже идентифицированы неблагоприятные аллельные варианты, предрасполагающие к заболеваниям.
Так, термолабильный вариант ключевого фермента синтеза цистеина — метилентетрагидрофолатредуктазы (MTHFR), ассоциирован с предрасположенностью к атеросклерозу и ишемической болезни сердца, с врожденными дефектами заращения невральной трубки, а также с нерасхождением хромосом в женском мейозе, приводящем к болезни Дауна.
Дефектный ген ангиотензинконвертирующего фермента (АСЕ) ассоциирован с развитием гипертрофии миокарда и гладкой мускулатуры сосудов, а также состоянием инсулинорезистентности, что имеет существенное значение в генезе эссенциальной гипертензии, инфаркта миокарда, инсулиннезависимого сахарного диабета, диабетической нефропатии и другой сосудистой патологии. Один из аллелей (Е4) гена аполипопротеина Е (АроЕ) ассоциирован не только с предрасположенностью к атеросклерозу, но и с болезнью Альцгеймера, хореей Гентинттона, некоторыми другими нейродегенеративными заболеваниями.
В последние годы были идентифицированы мутантные аллели гена СС16, предрасполагающие в гомозиготном состоянии (10% населения) к астме; мутации в гене фактора V свертывания крови резко увеличивают вероятность тромбозов; аллельные полиморфизмы гена TGF2 коррелируют с такими частыми аномалиями внутриутробного развития как расщелина верхней губы (заячья губа) и твердого неба (волчья пасть). Группа известных триггеров мультифакториальных заболеваний сегодня насчитывает более 50 генов и быстро увеличивается.
Наиболее опасным для возникновения многих болезней является сочетание неблагоприятных аллелей нескольких генов с аддитивным эффектом. В частности, индивидуумы с неблагоприятными аллелями генов микросомальной эпоксидгидролазы, СС16, интерлейкинов 4 и 9, а также альфа-1-антитрипсина имеют особенно высокий риск хронических пневмоний, обтурационных бронхитов, эмфиземы легких и астмы.
Особенно сложен генетический механизм возникновения наиболее распространенных мультифакториальных заболеваний, таких как диабет, атеросклероз, ишемическая болезнь сердца, большинство онкологических и нервно-психических заболеваний. Считают, что этиология и патогенез этих заболеваний зависят от неблагоприятного сочетания всех трех основных вариантов генов предрасположенности, т.е. проявления патологических мутаций соответствующих основных генов модифицируются эффектами генов-триггеров, генов детоксикации и генов рецепторов.
В заключение необходимо подчеркнуть, что 1) тестирование генов предрасположенности носит вероятностный характер. Оно не устанавливает диагноз, но выявляет лиц с повышенным риском развития той или иной патологии; 2) с помощью соответствующих мер и рекомендаций можно уберечь их от этих заболеваний; и 3) только наличия неблагоприятных аллелей недостаточно для развития заболевания.
6. Генетический паспорт
В настоящее время во многих диагностических центрах России широко применяются молекулярные методы с целью диагностики генных болезней, выявления гетерозиготного носительства патологических мутаций в семьях высокого риска, для досимптоматической диагностики болезней с поздней манифестацией и с целью идентификации личности (геномной дактилоскопии). Постепенно набирает силу генетическое тестирование в рамках предиктивной (предсказательной) медицины. Очевидно, что в результате этих исследований происходит накопление генетических данных как о геноме отдельных индивидуумов, так и о целых семьях, т.е. постепенно формируются индивидуальные и семейные базы ДНК-данных. Такая база ДНК-данных и является «генетическим паспортом». Информация, содержащаяся в этом уникальном документе, позволит учесть индивидуальные особенности своего генома, полнее реализовать свои врожденные способности и представляет несомненную ценность для потомков.
Черновой вариант генетического паспорта (персональная генетическая форма) уже существует de facto, и число генетических тестов, составляющих его основу, быстро увеличивается (рис. 7).
Важно отметить, что генетическая карта в полном варианте должна включать результаты исследования не только генов предрасположенности, но и бессимптомного носительства мутаций генов наиболее частых наследственных болезней (гемофилии, муковисцидоза, фенилкетонурии и др.). Кроме того, такой паспорт должен содержать информацию о кариотипе пациента, а также его уникальный генетический номер. В настоящее время диагностические возможности существующих молекулярных лабораторий и центров России позволяют обеспечить достаточно полный набор таких генетических тестов. Один из вариантов «генетического паспорта», разработанного в лаборатории пренатальной диагностики наследственных болезней НИИАГ им. Д.О. Отта РАМН, приведен на рис. 8.
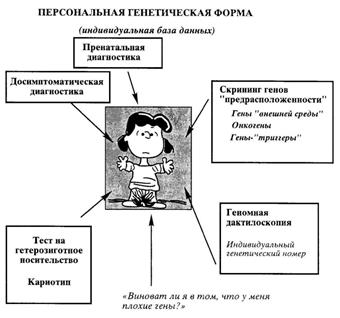
Рисунок 7 – Персональная генетическая форма
В ближайшем будущем такой генетический паспорт может быть рекомендован к применению в клинической практике, а генетическое тестирование станет столь же рутинным, как и другие лабораторные анализы (определение группы крови и резус-фактора, тесты на инфекционные болезни и пр.).
Согласно рекомендациям ВОЗ, генетическое тестирование должно проводиться с учетом добровольного, сознательного согласия тестируемого. Формально это означает, что важная генетическая информация может быть получена сравнительно поздно, когда ее полезность для обследуемого и его близких родственников уже в значительной мере утрачена. Однако, принимая во внимание значение этих данных для здоровья ребенка, гармоничного формирования его личности, рационального питания, эффективного образования, спортивных занятий, оптимальной профориентации и пр., составление такого генетического паспорта в раннем возрасте представляется вполне оправданным уже сегодня.

Рисунок 8 – Предполагаемый генетический паспорт
Весьма актуальным представляется генетическое тестирование для будущих супругов, спортсменов - профессионалов, людей экстремальных профессий и лиц, просто заинтересованных в информации о собственном геноме.
7. Геномная дактилоскопия
Изменчивость числа повторяющихся последовательностей ДНК человека служит основой для метода «отпечатков пальцев». Этот метод сегодня применяется в самых разных целях, от установления отцовства и нужд судебной медицины до выявления контрафактных мясных продуктов, в том числе китобойного промысла.
Минисателлиты и VNTR. Одна из наиболее важных для практики форм полиморфизма ДНК основана на изменчивости числа тандемно повторяющихся последовательностей между двумя сайтами рестрикции. Эти последовательности длиной 2—100 нуклеотидов представляют собой мини-сателлиты. Например, последовательность GGAAGGGAAGGGAAGGGAAG состоит из четырех тандемных повторов последовательности GGAAG. Кластеры таких последовательностей широко распространены в геноме человека. Обычно каждый повтор содержит от 14 до 100 нуклеотидов, а число повторов в каждом сайте варьирует от 2 до 100 и более. Эти локусы, называемые варьирующие по числу тандемные повторы (VNTR), рассматриваются в геномике человека как пример среднеповторяющихся последовательностей ДНК. Участки ДНК с разным количеством повторов представляют собой аллели VNTR. Многие локусы включают десятки аллелей, часто встречаются гетерозиготы.
Когда VNTR-последовательности разрезаются с помощью рестриктаз и анализируются при помощи Саузерн-блоттинга, выявляется специфическая картина распределения полос. Эта картина - один из примеров «отпечатков пальцев» ДНК.
Подобные картины - эквивалент подлинных отпечатков пальцев, так как они всегда неизменны для данного индивида (вне зависимости от того, какая ткань используется как источник ДНК) и различаются у разных индивидов. Фактически изменчивость распределения полос столь велика, что их профиль для каждого человека уникален. Метод «отпечатков пальцев» может быть использован при наличии очень маленького количества материала (менее 60 мкл крови) и для проб, имеющих большой возраст (удалось определить VNTR-профиль египетских мумий возрастом более 2400 лет), что повышает эффективность метода в различных обстоятельствах.
Применение VNTR-анализа в криминалистике. С 1988 г. в США результаты изучения ДНК с помощью метода «отпечатков пальцев» принимаются в качестве улик в криминалистике. Метод используется также для многих других целей, в том числе, для идентификации личности при иммиграции, подтверждения чистопородности собак, установления отцовства и исследований, связанных с охраной редких видов. Стандартное криминалистическое тестирование включает определение около десяти VNTR-локусов, которые находятся в разных хромосомах (рис. 9).

Рисунок 9 – Отпечатки пальцев ДНК в судебном деле. Профиль ДНК подозреваемого (S2) совпадает с профилем пробы крови, полученным в качестве улики (Е)
Результаты интерпретируются с помощью методов статистики, теории вероятностей и популяционной генетики. Частоты каждого аллеля в стандартном наборе VNTR-проб определены для многих популяций людей в разных регионах мира. С помощью этих данных можно рассчитать вероятность любой комбинации аллелей. Например, если определенный аллель в локусе 1 имеется у одного из 333 индивидов, а аллель в локусе 2 - у одного из 83, то вероятность их совместного присутствия в генотипе - 1/28000 (произведение их частот в популяции). Эта средняя вероятность не особенно доказательна, но если включить анализ аллеля третьего локуса (который имеется у 1 из 23 индивидов) и четвертого (имеется у 1 из 100 индивидов), то вероятность их комбинации — 1 из 70 миллионов. То есть вероятность, что кто-либо имеет именно эту комбинацию аллелей - 1/70000000, или всего 2 индивида на все население России.
Если «отпечатки пальцев» ДНК подозреваемых не совпадают с данными вещественных доказательств, эти люди могут быть исключены из числа предполагаемых преступников (что происходит примерно в 30% случаев). Если найдено совпадение между ДНК, обнаруженной на месте преступления, и ДНК подозреваемого, то существует две возможных интерпретации: или ДНК оставлена на месте преступления подозреваемым, или кем-либо еще, имеющим такую же картину полос. В данном случае «отпечатки пальцев» ДНК не доказывают, что подозреваемый виновен, но являются одним из фрагментов обшей картины, составляющей доказательную базу, который должен рассматриваться наряду с другими фактами.
Дата публикования: 2015-10-09; Прочитано: 2332 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
