 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы исследования ДНК
|
|
Сбор образцов. Чаще всего в качестве образца используют кровь больного. Необходимо помнить, что кровь для ДНК-диагностики собирают в отдельную пробирку с антикоагулянтом ЭДТА, но не гепарином. Соскоб со слизистой оболочки ротовой полости или слюна — также достаточный материал для определения любых изменений в ДНК. Кроме того, ДНК остается стабильной после высушивания образцов крови, что позволяет направлять их для анализа почтой в другие города и даже страны, а также обращаться к архивным материалам и биопсийным препаратам. Образцы тканей или ДНК можно замораживать для длительного хранения.
В основе большинства применяемых в клинической практике молекулярно-генетических тестов лежит ПЦР. Далее амплифицированную ДНК анализируют с помощью различных методов.
Полиморфизм длины амплифицированных фрагментов. Один из самых простых молекулярно-генетических методов — анализ полиморфизма длины амплифицированных фрагментов. Метод не предъявляет требований к условиям ПЦР, а продукты амплификации можно анализировать с помощью электрофореза в агарозном или акриламидном геле. Праймеры для ПЦР подбирают относительно легко, но так, чтобы с двух сторон ограничивать область полиморфизма. После проведения ПЦР продукты амплификации наносят на гель и проводят электрофорез в присутствии маркеров длины нуклеотидных фрагментов. Метод позволяет получать результат в течение 3-4 ч с момента доставки образца в лабораторию.
Это исследование позволяет определять небольшие вставки и делеции, а также различия в числе тандемных повторов (полиморфизм VNTR — variable number of tandem repeats), что используют в судебно-медицинской практике, при определении родства и при болезнях экспансии повторов. В настоящее время распространена модификация метода — количественная флюоресцентная ПЦР. Добавление флюоресцентных красителей к праймерам и использование капиллярного электрофореза позволяет проводить мультиплексные реакции с количественной оценкой амплификата. Этот метод применяют в пренатальной диагностике для определения анеуплоидии, делеций и вставок, где он заменяет трудоемкие цитогенетические методы.
Полиморфизм длины рестрикционных фрагментов (ПДРФ). Этот метод часто применяют для обнаружения однонуклеотидных замен. После амплификации в ПЦР фрагмента ДНК, содержащего место возможной замены нуклеотида, амплификат обрабатывают ферментом (рестриктазой). Благодаря специфичности действия рестриктазы, узнающей определенную короткую (обычно — от 4 до 6 букв) нуклеотидную последовательность, можно подобрать такие ферменты, которые будут разрезать только дикий или только мутантный тип аллеля. Продукты рестрикции разделяют с помощью электрофореза. По образованию полос в геле, соответствующих коротким, длинным или и тем, и другим фрагментам, определяют соответственно один и другой гомозиготный вариант или гетерозиготное состояние по данному аллелю (рис. 3).
Недостаток метода — существование дополнительной процедуры — рестрикции, удлиняющей время исполнения анализа до 3-24 ч в зависимости от протокола обработки рестриктазой. Кроме того, не во всех случаях однонуклеотидных замен удается подобрать специфичный для этого локуса фермент. Тем не менее, метод оценки ПДРФ — один из распространенных в диагностике, так как хорошо различает однонуклеотидные полиморфизмы, широко распространенные как при моногенных, так и при многофакторных заболеваниях.
Аллельспецифичная полимеразная цепная реакция - один из распространенных методов анализа точковых мутаций. Праймеры подбирают так, чтобы они оканчивались точно в месте мутации. В таком случае специфичность их взаимодействия с матрицей зависит от существования или отсутствия мутации (рис. 4). К сожалению, полимераза, используемая в ПЦР, часто продолжает работу даже при неполной комплементарности, что приводит к получению ложноположительных результатов ПЦР. В настоящее время метод чаще применяют в научно-исследовательских целях, а не в прикладных диагностических.
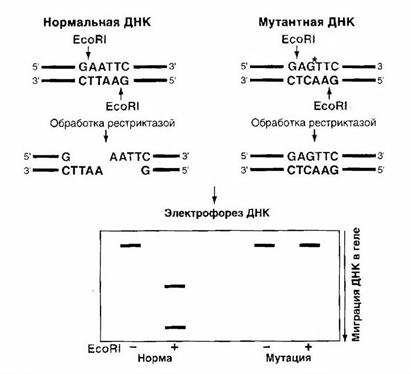
Рисунок 3- Схема рестрикции и электрофореза образцов при проведении анализа полиморфизма длины рестрикционных фрагментов [1]
Количественная полимеразная цепная реакция. С помощью добавления в смесь для ПЦР молекул, которые способны флюоресцировать при наработке продукта амплификации, удается не только чувствительность и специфичность реакции, но и получить точную количественную оценку содержания искомой матрицы в образце, а также в значительной степени ускорить и упростить протокол проведения анализа. Наибольшее распространение получили две разновидности количественной ПЦР (ПЦР в реальном времени). В первом случае в смесь добавляют флюорофор, который неспецифически взаимодействует с двойной спиралью ДНК и при этом многократно увеличивает уровень флюоресценции. Этот вариант отличается простотой оптимизации условий и дешевизной.
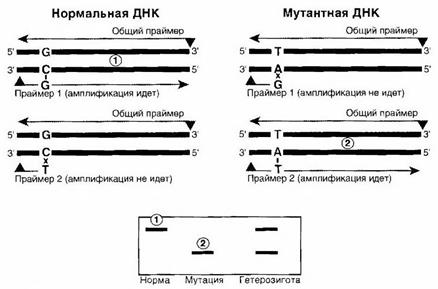
Рисунок 4- Схема аллельспецифичной ПЦР [1]
Во втором случае в смесь добавляют зонд — олигонуклеотид, специфичный для последовательности, которую амплифицируют (рис. 5). При прохождении реакции все большие его количества взаимодействуют с образующейся искомой ДНК. При этом полимераза в ходе своей работы разрушает зонд и высвобождает связанный с ним флюорофор, который начинает светиться. Чем больше синтезировано ПЦР-продуктов, тем более интенсивна флюоресценция.
Преимущество метода заключается в возможности использования разных флюорофоров для различных зондов и проведении нескольких реакций в одной пробирке. Количественная ПЦР не требует выполнения дополнительных процедур (например, электрофореза), что не только сокращает время проведения анализа, но и существенно снижает риск контаминации, так как флюоресценцию образцов анализируют в закрытых пробирках.
С помощью количественной ПЦР можно определять большой перечень мутаций: протяженные и небольшие делеции, однонуклеотидные полиморфизмы и дупликации, в том числе целых хромосом (анеуплоидии). В целом можно сказать, что количественная ПЦР в диагностике занимает самые прочные позиции, благодаря сочетанию высокой специфичности, чувствительности и скорости проведения анализа. В лабораториях с большим потоком анализов этим методом по возможности заменяют любые другие исследования, в том числе не требующие количественной оценки, поскольку его применение позволяет снизить риск контаминации образцов.
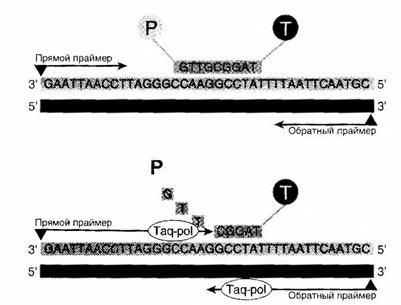
Рисунок 5- Схема количественной ПЦР в варианте с зондом [1]
Мультиплексная лигазозависимая амплификация (распространенный вариант в русскоязычной литературе без перевода — MLPA — multiple ligase dependent probe amplification) — относительно новый, дешевый, высокопроизводительный и специфичный метод анализа широкого спектра мутаций — однонуклеотидных полиморфизмов, небольших и крупных делеций. В основе метода лежит специфичное лигирование двух олигонуклеотидных проб (рис. 6), подобранных таким образом, что исследуемая мутация лежит на их стыке. Лигирование с помощью специальной высокоспецифичной лигазы происходит с очень высокой точностью, обеспечивающей распознавание комплементарного нуклеотида. При этом в каждую пробу вводят различную по длине маркерную последовательность, чтобы различать отдельные аллели, а концы проб замыкают универсальными праймерами. В результате амплификации лигированных проб получают набор продуктов с длинами, соответствующими различным аллелям. В одной реакции без труда можно анализировать десятки аллелей, если продукты амплификации подвергать капиллярному электрофорезу. Более того, амплитуда пиков при капиллярном электрофорезе — высоковоспроизводимая характеристика набора ампликонов, что дает возможность определять дозу гена — диагностировать потерю гетерозиготности или, напротив, амплификацию гена, в целом метод применим для диагностики большинства мутаций: замены, делеции и вставки (как однонуклеотидной, так и протяженной). Он также находит применение в пренатальной диагностике анеуплоидии.
Секвенирование — «золотой стандарт» молекулярной генетики, с его помощью можно провести поиск новых, редких и подтверждение известных мутаций. Диагностика многих наследственных заболеваний включает проведение секвенирования: предрасположенность к раку яичников и молочной железы (ВЕСА1 и ВКСА2), нейрофиброматоз, фенилкетонурия, муковисцидоз и др. При отсутствии распространенных мутаций, приводящих к наследственному заболеванию, часто секвенируют ген для обнаружения более редких или новых мутаций.
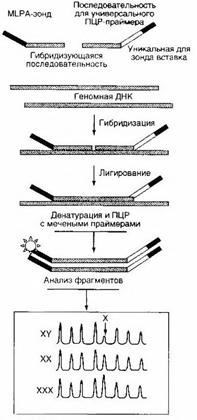
Рисунок 6 - Схема мультиплексной лигазозависимой амплификации [1]
Для некоторых генов, имеющих небольшие размеры, прямое секвенирование с успехом применяют в качестве основного метода сканирования мутаций. Например, удобным оказалось его применение для определения мутаций в гене фактора IX свертывания крови (гемофилия В). Один из существенных недостатков технологии секвенирования — его дороговизна, но из года в год снижать его стоимость позволяет применение новых методик.
Масс-спектрометрия. Для молекулярно-генетического анализа на масс-спектрометре подбирают олигонуклеотиды встык к исследуемому полиморфизму, после чего их наращивают на один нуклеотид, комплементарный изучаемому. Масс-спектрометр позволяет быстро и точно определить добавленный нуклеотид. Для проведения анализа также требуются предварительная амплификация последовательности в ПЦР и последующая очистка амплификата перед гибридизацией со специфической пробой. Дополнительные процедуры и использование специальных реагентов становятся оправданными при проведении большого количества однотипных тестов. Этот метод позволяет оценивать однонуклеотидные замены и небольшие делеции и вставки. Кроме того, оценка соотношения множества пиков полиморфизмов в гетерозиготном состоянии позволяет обнаруживать анеуплоидию. Производительность прибора составляет сотни анализов в сутки.
Биологические микрочипы заняли свою нишу в основном в научных исследованиях, но используются и диагностике. Чипы — небольшие (2-10 см2) полимерные или стеклянные пластины либо мембраны, на которые нанесено от сотен до десятков тысяч различных биологических проб: ДНК, РНК, белки или клетки. В зависимости от этих зондов различают ДНК-, РНК-, белковые и клеточные микрочипы. Наибольшее распространение получили ДНК-чипы. Их используют для анализа спектра мутаций или аллельных вариантов разных генов, а также для анализа экспрессии генов.
Микрочиповая технология за счет экономии реактивов и пространства позволяет проводить тысячи анализов одновременно с использованием минимальных количеств материала (например, изучать экспрессию десятков генов в образце опухолевой ткани при определении прогноза лечения). С помощью ДНК-чипов можно анализировать как протяженные, так и короткие транслокации, дупликации и делеции.
Технология приготовления микрочипов в настоящее время коммерциализирована, и многочисленные фирмы (в том числе в России) могут по заказу подготовить любой вариант чипа. Интерес к использованию микрочипов в клинической практике связан, в частности, с поиском ассоциаций генетических полиморфизмов с заболеваниями и использованием этой технологии в предсказательной медицине. Биологические чипы создают для диагностики конкретных заболеваний, поиска полиморфных систем генов детоксикации и фармакогенетически оправданного лекарственного лечения лейкозов, туберкулеза и бронхиальной астмы.
Метилспецифичная полимеразная цепная реакция. В ряде случаев причиной заболевания служит не изменение нуклеотидной последовательности генов, а сбой регуляторных механизмов реализации программы генома. Среди так называемых эпигенетических причин дисфункции наиболее широко известны нарушения метилирования СрG-динуклеотидов в регуляторных, часто промоторных, областях различных генов. Чаще всего такие изменения возникают в злокачественных опухолях. Среди наследственных синдромов, вызванных ошибками метилирования, наибольшую известность получили синдромы Прадера-Вилли, Ангельмана и Беквита-Видеманна.
Суть метилспецифичной реакции состоит в том, что ДНК обрабатывают бисульфитом натрия, в результате чего все неметилированные остатки цитозина конвертируются в урацил, а метилированные не изменяются. После этого проводят ПЦР с праймерами, соответствующими метилированной и неметилированной последовательностям. По тому, с какой парой праймеров происходит амплификация, можно судить о метилировании. Этот метод относительно дешев и прост. Он нашел применение в диагностике злокачественных новообразований и болезней импринтинга.
Метилчувствительная полимеразная цепная реакция. В ряде случаев в области изучаемого СрG-динуклеотида можно найти последовательность, распознаваемую особыми ферментами — метилчувствительными рестриктазами. В отличие от обычных рестриктаз активность этих ферментов зависит от состояния метилирования СрG-динуклеотида, входящего в состав специфичной для фермента последовательности. При метилировании ДНК становится устойчивой к действию фермента.
Бисульфитный сиквенс. Проводится обработка ДНК бисульфитом с последующим секвенированием, что позволяет выявлять метилированные нуклеотиды в масштабах всего генома. Прогнозируется развитие новых методов диагностики уровня метилирования генов на основе не только секвенирования, но и микрочиповых технологий.
Методы мутационного скрининга. Если характер мутации неизвестен, а клиническая картина заболевания позволяет предположить, в каких генах могла произойти мутация, то в лабораторной диагностике наследственных болезней нередко прибегают к разработке индивидуальной (семейной) диагностической процедуры и применяют комплекс исследовательских методов поиска новых мутаций, в том числе анализ перестроек ДНК-блоттингом по Саузерну; анализ полиморфизма конформации одноцепочной ДНК; гетеродуплексный анализ и др.
В настоящее время разрабатывают методы неинвазивной пренатальной молекулярно-генетической диагностики. В этом случае в качестве материала для анализа используют кровь матери (ткани плода при заборе материала не затрагивают), которая во время беременности содержит не только плодные клетки, но и внеклеточные ДНК и РНК плода. Такое тестирование требует использования современного высокопроизводительного оборудования, позволяющего анализировать миллионы генных последовательностей. Это поможет распознать и правильно генотипировать молекулы плода, составляющие лишь 4-10% общей внеклеточной ДНК.
С этой целью применяют системы параллельного секвенирования или масс-спектрометрии. В ноябре 2011 г. состоялся запуск коммерчески доступной неинвазивной пренатальной диагностики синдрома Дауна компанией «Секвеном» (США). Тест основан на технологии массового параллельного секвенирования. Учитывая экспоненциальное удешевление секвенирования наряду с повышением его точности и скорости, в ближайшие три года можно предполагать создание коммерчески доступных неинвазивных пренатальных тестов как на распространенные хромосомные, так и генные заболевания. Другая задача, с которой могут справиться системы параллельного секвенирования, — просеивающее тестирование новорожденных.
В настоящее время в России с помощью этого тестирования определяют пять заболеваний новорожденных: фенилкетонурию, муковисцидоз, адреногенитальный синдром, врожденный гипотиреоз и галактоземию. Во всех случаях в качестве первого метода используют биохимический анализ крови новорожденного. В случае подозрения проводят ДНК-диагностику.
Развитие технологий секвенирования позволит не только существенно расширить перечень диагностируемых заболеваний, но и сократить в конечном итоге стоимость неонатального тестирования.
Дата публикования: 2015-10-09; Прочитано: 2823 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
