 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Глава 1. РАСТВОРЫ
|
|
1.1. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Изучение данной темы способствует формированию следующих компетенций: ОК-1, ПК-2, ПК-3.
Теоретическое пояснение: количественный состав растворов выражают концентрацией и дольными способами. Под концентрацией раствора понимают содержание растворённого вещества (в г или моль) в единице массы или объёма раствора или растворителя.
Различают приближённые и точные способы. К приближённым относятся понятия разбавленный, концентрированный, ненасыщенный, насыщенный и пересыщенный растворы. К точным способам выражения концентрации относятся:
Массовая доля растворённого вещества w(Х) представляет собой отношение массы растворённого вещества m(X) к массе раствора m(p-pа):  ; это безразмерная величина, выражаемая в долях единицы, в сотых долях или процентах (%), в тысячных долях или промилле (%о), в миллионных долях или в млн - 1. Например, w(Х) = 0,005 = 0,5% = 5 %о = 5000 млн-1.
; это безразмерная величина, выражаемая в долях единицы, в сотых долях или процентах (%), в тысячных долях или промилле (%о), в миллионных долях или в млн - 1. Например, w(Х) = 0,005 = 0,5% = 5 %о = 5000 млн-1.
В медицинской литературе массовую долю принято выражать в грамм-процентах (г%) (равнозначно процентам), миллиграмм-процентах (мг% или 10-3 г%) и в микрограмм-процентах (мкг%или 10-6 г%). Таким образом, w(Х) = 0,005 = 0,5% = 0,5 г% = 500 мг% = 500000 мкг%. Например, 5%-ный раствор - это пятипроцентный раствор или раствор с массовой долей растворённого вещества, равной 5% или 0,05.
Молярная (мольная) доля c(X) представляет собой отношение количества вещества компонента раствора n(X i) к общему количеству всех компонентов Sn(X i), составляющих раствор: 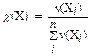 . Это безразмерная величина, выражаемая в долях единицы или процентах.
. Это безразмерная величина, выражаемая в долях единицы или процентах.
Объёмная доля j(X) представляет собой отношение объёма компонента раствора (жидкости) V(X) к общему объёму раствора (смеси жидкостей) V(р-р):  . И эта безразмерная величина может выражаться как в долях единицы, так и в процентах.
. И эта безразмерная величина может выражаться как в долях единицы, так и в процентах.
Молярная концентрация С(Х) представляет собой отношение количества вещества компонента раствора n(X) к объёму раствора V(р-р):
 ; размерность - моль/л. Например, 0,1 М раствор означает децимолярный раствор или раствор с молярной концентрацией растворённого вещества, равной 0,1 моль/л.
; размерность - моль/л. Например, 0,1 М раствор означает децимолярный раствор или раствор с молярной концентрацией растворённого вещества, равной 0,1 моль/л.
Молярная концентрация эквивалента (или нормальная концентра-ция)  представляет собой отношение количества вещества эквивалента в растворе n(
представляет собой отношение количества вещества эквивалента в растворе n( ) к объёму раствора:
) к объёму раствора:  ; размерность - моль/л.
; размерность - моль/л.
Понятие «эквивалент вещества» связано с конкретной реакцией, в которой вещество участвует. Эквивалент ( ) - это реальная или условная частица вещества Х, которая в обменной реакции вступает в реакцию с одним протоном (ионом водорода) или замещает его в соединениях, или в окислительно-восста-новительной реакции отдает или присоединяет один электрон. Одноосновные кислоты и однокислотные основания всегда имеют единичный эквивалент (это реальная частица, молекула Х). В других случаях одно и тоже вещество может иметь несколько эквивалентов. Так, случае многоосновных кислот и многокислотных оснований, солей эквивалентом может быть реальная молекула Х или её какая-то часть (доля) -
) - это реальная или условная частица вещества Х, которая в обменной реакции вступает в реакцию с одним протоном (ионом водорода) или замещает его в соединениях, или в окислительно-восста-новительной реакции отдает или присоединяет один электрон. Одноосновные кислоты и однокислотные основания всегда имеют единичный эквивалент (это реальная частица, молекула Х). В других случаях одно и тоже вещество может иметь несколько эквивалентов. Так, случае многоосновных кислот и многокислотных оснований, солей эквивалентом может быть реальная молекула Х или её какая-то часть (доля) -  . Число, показывающее долю реальной частицы, эквивалентной одному иону водорода в реакциях кислотно-основного типа или одному электрону - в окислительно-восстановительных реакциях, называется фактором эквивалентности (f экв.(Х) или
. Число, показывающее долю реальной частицы, эквивалентной одному иону водорода в реакциях кислотно-основного типа или одному электрону - в окислительно-восстановительных реакциях, называется фактором эквивалентности (f экв.(Х) или  ). Он определяется исходя из конкретной химической реакции.
). Он определяется исходя из конкретной химической реакции.
Примеры определения эквивалентов различных веществ в различных реакциях приведены в таблицах 1 и 2.
Если кислотно-основная реакция протекает до конца, то при нахождении фактора эквивалентности кислот, оснований и солей следует учесть, что z - это основность кислоты или кислотность основания, а в случае солей - произведение числа атомов металла, образующего соль, на его валентность.
Если в химической реакции участвуют два вещества Х1 и Х2, то по закону эквивалентов количество эквивалента одного вещества n( 1) равно количеству эквивалента второго вещества n(
1) равно количеству эквивалента второго вещества n( 2), т.е.: n(
2), т.е.: n( 1) = n(
1) = n( 2).
2).
По закону эквивалентов, если взаимодействуют растворы двух веществ V(p-р X1) и V(p-p X2) с нормальной концентрацией 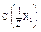 и
и  , cоответственно и титром t(X1) и t(X2), то:
, cоответственно и титром t(X1) и t(X2), то:
 ;
; 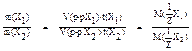 .
.
Таблица 1
Определение эквивалента вещества в реакциях кислотно-основного типа.
| Уравнение реакции | Эквивалент вещества Х или 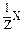
| Фактор эквива-лент-ности | Молярная масса эквивалента М( )= )= 
|
| H3PO4 + 2KOH = K2HPO4 + 2H2O «Х» 2 эквивалента KOH | ½ моль Н3РО4 | 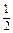
| 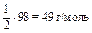
|
| H3PO4 + 3KOH = K3PO4 + 3H2O «Х» 3 эквивалента KOH | 1/3 моль Н3РО4 | 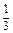
| 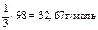
|
| Al2(SO4)3 + 4KOH = [Al(OH)2]2SO4 + K2SO4 «Х» 4 эквивалента KOH | ¼ моль Al2(SO4)3 | 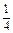
| 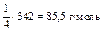
|
| Mg(OH)2+H2SO4= (MgOH)2SO4 +2H2O 2 эквивалента | 1 моль Mg(OH)2 | M(Mg(OH)2 = 58 г/моль |
Таблица 2.
Определение фактора эквивалентности и молярной массы эквивалента в окислительно-восстановительных реакциях
| Уравнение реакции | Эквивалент вещества Х или 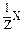
| Фактор эквива-лент-ности | Молярная масса эквивалента
М( )= )= 
|
I2 + 5Cl2 + 12KOH= 2KIO3 +10KCl + 6H2O
I2 + 5Cl2 + 12OH- = 2IO3- +10Cl-+6H2O
 I2 + 12OH--10e- = 2IO3- + 6H2O 1
«Х» 10 эквивалентов e-
Cl2 + 2e- = 2Cl- 5
«Х» 2 эквивалента e- I2 + 12OH--10e- = 2IO3- + 6H2O 1
«Х» 10 эквивалентов e-
Cl2 + 2e- = 2Cl- 5
«Х» 2 эквивалента e-
| 1/10 моль I2 ½ моль Cl2 |

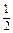
| 
|
 Cr2(SO4)3 + 3H2O2 + 10KOH = 2K2CrO4 + K2SO4 + 8H2O
2Cr3+ + 3H2O2 +10OH- = Cr2(SO4)3 + 3H2O2 + 10KOH = 2K2CrO4 + K2SO4 + 8H2O
2Cr3+ + 3H2O2 +10OH- =  +4H2O
2Cr3+ +8OH--6e- = +4H2O
2Cr3+ +8OH--6e- =  + 4H2O 1
«Х» 6 эквивалентов e-
H2O2 + 2е- = 2ОH- 3 «Х» 2 эквивалента e- + 4H2O 1
«Х» 6 эквивалентов e-
H2O2 + 2е- = 2ОH- 3 «Х» 2 эквивалента e-
| 1/6 моль Cr2(SO4)3 ½ моль Н2О2 |

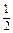
|

|
Моляльность (моляльная концентрация) раствора в (Х) представляет собой отношение количества растворённого вещества v (X) к массе растворителя m(р-тель):
 ; размерность - моль/кг.
; размерность - моль/кг.
Титр (или массовая концентрация) t(X) представляет собой отношение массы растворённого вещества к объёму раствора:
 ; размерность - г/мл.
; размерность - г/мл.
Формулы, позволяющие производить расчёт различных видов концентраций раствора приведены в таблице 3.
Таблица 3.
Таблица 3.
Связь между различными способами выражения концентрации растворов.
| Способ выражения концентрации, обозначение, размерность | Формула пересчёта |
| Молярная концентрация, С(Х), моль/л | 
|

| |

| |
Молярная концентрация эквивалента (нормальная концентрация), С( ) или N, моль/л ) или N, моль/л
| 
|
| z. C(X) | |

| |
| Титр, t(X), г/мл | 
|
| Моляльная концентрация, в (Х) или Сm(X), моль/кг растворителя | 
|
Дата публикования: 2015-09-18; Прочитано: 738 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
