 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химическая организация клетки
|
|
4.1. Основные химические элементы клетки и их значение для жизнедеятельности организмов
В клетках живых организмов обнаружено около 70 элементов периодической системы элементов Д.И. Менделеева. Все эти элементы встречаются и в неживой природе, что указывает на единство живой и неживой природы.
Содержание химических элементов существенно отличается в клетках живых организмов и в Земной коре. Имеються различия в составе и биологической роли химических элементов в клетках растений и животных.
| ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ |
| МАКРОЭЛЕМЕНТЫ › 99% О, С, Н, N, P, K, Cl, Ca, Mg, Na, Fe |
| МИКРОЭЛЕМЕНТЫ ≈0,01% I, Co, Mn, Cu идр. |
| УЛЬТРАМИКРОЭЛЕМЕНТЫ От 10-4 до 10-6% Pb, Br,Ag и др. |
Отдельную групу среди макроелементов составляют органогенные элементы (O, C, H, N), которие образуют молекулы всех органических веществ.
Макроэлементы, их роль в клетке. Органогенные элементы - кислород, углерод, водород и азот составляют ≈ 98% химического содержания клетки. Они легко образуют ковалентные связи за счет обобщения двух электронов (по одному от каждого атома) и благодаря этому формируют большое разнообразие органических веществ в клетке.
Жизненно важными являются и другие макроэлементы в клетках животных и человека (калий, натрий, магний, кальций, хлор, железо), на долю которых приходится около 1,9%.
Так, ионы Калия и Натрия регулируют осмотическое давление в клетке, обуславливают нормальный ритм сердечной деятельности, возникновение и проведение нервного импульса. Ионы Кальция принимают участие в свертывание крови, сокращении мышечных волокон. Нерастворимые соли Кальция принимают участие в формировании костей и зубов.
Ионы магния играют важную роль в функционировании рибосом и митохондрий. Железо входит в состав гемоглобина.
Микроэлементы, их роль в клетке. Биологическая роль микро- и ультрамикроэлементов определяется не их процентным содержанием, а тем, что они входят в состав ферментов, витаминов и гормонов. Например, Кобальт входит в состав витамина В12, Йод – в состав гормона тироксина, Медь – в состав ферментов, катализирующих окислительно-востановительные процессы.
Ультрамикроэлементы, их роль в клетке. Их концентрация не привышает 0,000001 %. Это такие элементы: золото, серебро, свинец, уран, селен, цезий, берилий, радий, и др. Физиологическая роль многих химических элементов еще не установлена, но они необходимы для нормального функционирования организма. Например, дефицит ультрамикроэлемента Селена приводит к развитию раковых заболеваний.
Обобщенные сведения о биологическом значении основных химических элементов, содержащихся в клетках живых организмов, представлены в таблице 4.1.
При недостаче важного химического элемента в почве определенного региона, что обусловливает дефицит его в организме местных жителей, возникают так называемые эндемические болезни.
Все химические элементы содержатся в клетке в виде ионов или входят в состав химических веществ.
Табл. 4.1.Основные химические элементы клетки и их значение для жизнидеятольности организмов
| Элемент | Символ | Содержание | Значение для клетки и организма |
| Углерод | o | 15—18 | Главный структурный компонент всех органических соединений клетки |
| Кислород | N | 65—75 1,5—3,0 | Главный структурный компонент всех органических соединений клетки |
| Азот | H | 8—10 | Обязательный компонент аминокислот |
| Водород | K | 0.0001 | Главный структурный компонент всех органических соединений клетки |
| Фосфор | S | 0,15—0,4 | Входит в состав костной ткани и зубной эмали, нуклеиновых кислот, АТФ и некоторых ферментов |
| Калий | Cl | 0,15—0,20 | Содержится в клетке только в виде ионов, активирует ферменты белкового синтеза, обуславливает ритм сердечной деятельности, участвует в процессах фотосинтеза |
| Сера | Ca | 0,05—0,10 | Входит в состав некоторых аминокислот, ферментов, витамина В |
| Хлор | Mg | 0,04—2,00 | Важнейший отрицательный ион в организме животных, компонент НС1 в желудочном соке |
| Кальций | Na | 0,02—0,03 | Входит в состав клеточной стенки растений, костей и зубов, активирует свертывание крови и сокращение мышечных волокон |
| Магний | Fe | 0,02-0,03 | Входит в состав молекул хлорофилла, а также костей и зубов, активирует энергетический обмен и синтез ДНК |
| Натрий | I | 0,010—0,015 | Содержится в клетке только в виде ионов, обуславливаетнормальный ритм сердечной деятельности, влияет на синтез гормонов |
| Железо | Cu | 0,0001 | Входит в состав многих ферментов, гемоглобина и миоглобина, участвует в биосинтезе хлорофилла, в процессах дыхания и фотосинтеза |
| Йод | Mn | 0,0002 | Входит в состав гормонов щитовидной железы |
| Медь | Mo | 0.0001 | Входит в состав некоторых ферментов, участвует в процессах кровообразования, фотосинтеза, синтеза гемоглобина |
| Марганец | Co | 0,0001 | Входит в состав некоторых ферментов или повышает их активность, принимает участие в развитии костей, ассимиляции азота и процессе фотосинтеза |
| Молибден | Zn | 0.0001 | Входит в состав некоторых ферментов, участвует н процессах связывания атмосферного азота растениями |
| Кобальт | o | 0,0003 | Входит в состав витамина В12, участвует в фиксации ат- мосферного азота растениями, развитии эритроцитов |
| Цинк | N | 15—18 | Входит в состав некоторых ферментов, участвует в синтезе растительных гормонов (фуксина) и спиртовом брожении |
4.2. Химические вещества клетки
| ХИМИЧЕСКИЕ ВЕЩЕСТВА |
| НЕОРГАНИЧЕСКИЕ |
| ОРГАНИЧЕСКИЕ |
| ВОДА 85-90% |
| МИНЕРАЛЬНЫЕ СОЛИ 1-1,5% |
| ГАЗЫ (О2,СО2) |
| БЕЛКИ 7-10 % |
| ЛИПИДЫ 1-2 % |
| НУКЛЕИНОВЫЕ КИСЛОТЫ 1-1,5 % |
| УГЛЕВОДЫ 0,2-2 % |
4.2.1. НЕОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ: ВОДА И МИНЕРАЛЬНЫЕ СОЛИ
ВОДА, ЕЕ РОЛЬ В КЛЕТКЕ И ОРГАНИЗМЕ
Вода – самое распространенное соединение на Земле и в живых организмах. Содержание воды в клетках зависит от характера обменных процессов: чем они интенсивнее, тем выше содержание воды.
Так, ее содержание в разных клетках человека колебался от 10% - в эмали зубов до 80-85%, в нервных клетках, клетках легких, сердца, почек и до 97% в клетках развивающегося зародыша.
В среднем в клетках взрослого человека содержится 60-70% воды. При потере 20% воды организмы гибнут. Без воды человек может прожить не более 7 дней, тогда как без пищи не более 40 дней.
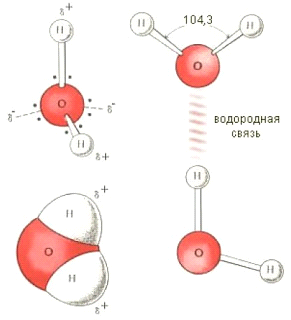

Рис. 4.1. Пространственная структура молекулы воды (Н2О) и образование водородной связи
Молекула воды (Н2О) состоит из двух атомов водорода, которые ковалентно связаны с атомам кислорода. Молекула полярная, потому что она изогнута под углом и ядро атома кислорода оттягивает обобществленные электроны к этому углу, так что кислород приобретает частичный отрицательный заряд, а находящиеся на открытых концах атомы водорода – частично положительные заряды. Молекулы воды способны притягиваться одна к другой положительным и отрицательным зарядом, образуя водородную связь (рис.4.1.).
Благодаря уникальной структуре молекул воды и их способности связываться друг с другом при помощи водородных связей вода обладает рядом свойств определяющих ее важную роль в клетке и организме.
Водородные связи обуславливают относительно высокие температуры кипения и испарения, высокую теплоемкость и теплопроводность воды, свойство универсального растворителя.
Водородные связи слабее ковалентных в 15-20 раз. В жидком состоянии водородные связи то образуются то разрываются, что обуславливает движение молекул воды, ее текучесть.
Биологическая роль Н2О
Вода определяет физические свойства клетки – ее объем, упругость (тургор). В клетке содержится 95-96 % свободной воды и 4-5% связанной. Связанная вода образует водные (сольватные) оболочки вокруг определенных соединений (например, белков), препятствуя их взаимодействию между собой.
Свободная вода является хорошим растворителем для многих неорганических и органических полярных веществ. Вещества хорошо растворимые в воде называются гидрофильными. Например, спирты, кислоты, газы, большинство солей Натрия, Калия и др. Для гидрофильных веществ энергия связи между их атомами меньше, чем энергия притяжения этих атомов к молекулам воды. Поэтому их молекулы или ионы легко встраиваются в общую систему водородных связей воды.
Вода как универсальный растворитель играет чрезвычайно важную роль, поскольку большинство химических реакций происходит в водных растворах. Проникновение веществ в клетку и выведение из нее продуктов жизнедеятельности в большинстве случаев возможно только в растворенном виде.
Неполярные (не несущие заряда) вещества вода не растворяет, поскольку не может образовать с ними водородные связи. Нерастворимые в воде вещества называются гидрофобными. К ним относятся жиры, жироподобные вещества, полисахариды, каучук.
Некоторые органические молекулы имеют двойные свойства: на одних участках их расположены полярные группы, а на других – неполярные. Такие вещества называют амфипатическими, или амфифильними. К ним относятся белки, жирные кислоты, фосфолипиды, нуклеиновые кислоты. Амфифильные соединения играют важную роль в организации биологических мембран, комплексных надмолекулярных структур.
Вода принимает непосредственное участие в реакциях гидролиза – расщепления органических соединений. При этом под действием специальных ферментов к свободным валентностям органических молекул присоединяются ионы ОН- и Н+ воды. В результате образуют новые вещества с новыми свойствами.
Вода обладает большой теплоемкостью (т.е. способностью поглощать тепло при незначительных изменениях собственной температуры) и хорошей теплопроводностью. Благодаря этим свойствам температура внутри клетки (и организма) поддерживается на определенном уровне при значительных перепадах температуры окружающей среды.
Важное биологическое значение для функционирования растений, холоднокровных животных имеет то, что под влиянием растворенных веществ (углеводов, глицерина) вода может изменять свои свойства, в частности температуру замерзания и кипения.
Свойства воды настолько важны для живых организмов, что нельзя представить существование жизни, в том виде как мы ее знаем, не только на Земле, но и на любой другой планете без достаточного запаса воды.
МИНЕРАЛЬНЫЕ СОЛИ
Могут пребывать в растворенном или нерастворенном состоянии. Молекулы минеральных солей в водном растворе распадаются на катионы и анионы.
НАЙБОЛЕЕ РАСПОСТРАНИЕ ИОНЫ ЖИВЫХ ОРГАНИЗМОВ
КАТИОНЫАНИОНЫ
Н+ - Водорода OH- - гидроксида
К+ - Калия Cl- - хлоридной кислоты
Nа+ - Натрия SO42- сульфатной кислоты
Ca2+- Кальция H2PO4- фосфатной кислоты
Mg2+ - Магния HCO3- угольной кислоты
Функции минеральных солей:
1) Катионы и анионы минеральных солей играют важную роль в поддержании осмотического давления;
2) Анионы фосфорной кислоты создают фосфатную буферную систему, подерживающую рН клетки на уровне 6,9-7,0;
3) Угольная кислота и ее анионы формируют бикарбонатную буферную систему, поддерживающую рН плазмы сыворотки крови на уровне 7,36-7,4.
Существенным является не только содержание, но и соотношение веществ в клетке. Так, разность концентраций ионов К+ и Na+ внутри и на поверхности клетки обуславливает возникновение разности электрических потенциалов на клеточных мембранах, что лежит в основе нервного мышечного возбуждения. С разностью концентраций ионов на поверхности и внутри клетки связаны процессы преобразования энергии, перенос веществ через мембрану.
Многие минеральные компоненты входят в состав биологически важных для клетки соединений. Так, Фосфор входит в состав ДНК, РНК и АТФ, Азот и Сера – в состав белков, Купрум – в состав многих ферментов, Ферум – в молекулу гемоглобина, Цинк – в гормон поджелудочной железы, Йод – в гормоны щитовидной железы (тироксин), Кобальт – в состав витамина В12.
Нерастворимые соли (СаСО3, Са(РО4)2 и др.) входят в состав костной ткани зубов позвоночных, раковин и панцирей одноклеточных и многоклеточных животных, придавая им прочность.
4.2.2 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Подавляющая часть молекул клетки, исключая воду, относятся к органическим соединениям, химическую основу которых составляют атомы Углерода. Атомы Углерода ковалентно соединяются между собой и другими биогенными элементами (Н, О, Р, N, S), образуя большое разнообразие органических молекул.
Органические вещества клетки представлены сравнительно небольшими молекулами (аминокислоты, азотистые основания, свободные жирные кислоты, органические кислоты, их эфирами) и биологическими полимерами.
Биологические полимеры – это высокомолекулярные органические соединения (молекулярная масса 103 – 109 дальтон), макромолекулы которых состоят из простых молекул – мономеров. К биополимерам относятся белки, нуклеиновые кислоты, полисахариды (целлюлоза, крахмал, гормоны, АТФ, гликоген, хитин и др.). Мономерами их являются соответственно аминокислоты, нуклеотиды и моносахариды.
Полимеры, которые состоят из одинаковых мономеров называются гомополимерами. Если в состав полимеров входят разные мономеры, то они называются гетерополимерами.
УГЛЕВОДЫ
Органические соединения, в состав которых входит С, Н, О. общая формула углеводов Сn(Н2О)m ,где n и m могут иметь разное значение.
| Классификация углеводов |
| Моносахариды Сn(Н2О)m n-от 3 до 9 |
| Триозы(3С),тетрозы(4С), пентозы(5С), гексозы(6С); растворимые в воде, имеют сладкий вкус |
| Дисахариды,сахароза, лактоза, мальтоза, растворимые в воде, имеют сладкий вкус |
| Крахмал, гликоген, целлюлоза, хитин нерастворимы или плохо растворимы в воде, не имеют вкуса |
| Олигосахариды Имеют от 2 до 10 звеньев моносахаридов |
| Полисахариды Имеют более 10 звеньев моносахаридов |
Углеводы образуются в процессе фотосинтеза и могут использоваться в дальнейшем для синтеза аминокислот, жирных кислот и других соединений.
Обычно в клетке животных содержится около 1% углеводов (в клетках печени до 5%), в растительных клетках – до 9%
Функции углеводов:
1. Энергетическая. В процессе окисления 1 г глюкозы освобождается 17,6 кДж энергии. Крахмал у растений и гликоген у животных служат энергетическим резервом в клетках.
2. Пластическая (строительная):
- целлюлоза образует стенки растительных клеток;
- хитин является структурным компонентом покровов членистоногих и клеточных стенок многих грибов;
- рибоза входит в состав РНК и АТФ, дезоксирибоза является компонентом ДНК.
ЛИПИДЫ
Липиды – разнообразные по структуре органические соединения, которые хорошо растворяются в неполярных жидкостях (ацетон, эфир, хлороформ, бензин, ксилол и др.), но практически нерастворимы в воде.
Именно нерастворимость в воде делает липиды важнейшим компонентом мембран, разделяющих клетки на отсеки, или компартменты, заполненные водным содержимым.
Кроме того, липиды – это главная форма хранения энергии в животном организме, поскольку они химически инертны и могут хранится в концентрированном виде (без воды).
Липиды составляют 10-20% массы тела человека. Их содержится 10-12 кг из них 2-3 кг структурных, остальные – резервные. Особенно много липидов в нервной ткани, сердце, печени, почках и крови человека.
Среди липидов принято выделять жиры (нейтральные липиды) и липоиды (жироподобные вещества): фосфолипиды, стероиды, гликолипиды, воски и др.
| Жиры – производные трехатомного спирта глицерина и остатков жирных кислот |
| Твердые, с высокой t пл |
| В их составе преобладают насыщенные жирные кислоты |
| Преимущественно животные жиры |
| Жидкие (масла), с низкой t пл |
| Содержат много ненасыщенных жирных кислот |
| Рыбьей жир, растительные масла |
Функции жиров:
1. Энергетическая. При окислении 1г жира выделяется 38,9 кДж энергии, которая идет на образование АТФ;
2. Запасающая. В форме жиров хранятся резервные энергетические запасы организма;
3. Источник воды - у животных пустынь (верблюды, тушканчики). При расщеплении 1 кг жира выделяется 1,1 кг воды;
4. Защитная. Жировые отложения защищают внутренние органы от механических повреждений;
5. Теплоизоляционная. Благодаря низкой теплопроводимости слой подкожного жира предотвращает тепловые потери. Особенно это важно для животных, обитающие в условия холодного климата.
Любое избыточное количество сахара, съеденного животным и не израсходованное сразу на энергетические нужды, быстро превращается в жиры.
Фосфолипиды - сложные соединения глицерина и жирных кислот, которые содержат остаток фосфорной кислоты. Фосфолипиды имеют полярную (гидрофильную) головку и неполярные (гидрофобные) хвосты, что и определяет их ключевую роль в организации биологических мембран.
Гликолипиды – соединения липидов с углеводами. Входят в состав тканей головного мозга и нервных волокон.
Воски – покрывают кожу, волосы у млекопитающих, перья у птиц и делают их более эластичными, предохраняют от влаги.
Стероиды (стиролы)- построены на основе спирта холестерола. К стероидам относят желчные кислоты, витамин Д, гормоны коры надпочечников, половые гормоны, холестерол (холестерин) и др.
Стероид холестерол – играет важную роль в процессах образования стероидных половых гормонов, кортикостероидов, желчных кислот и др.
У ряда животных уровень холестерина в организме регулируется по принципу обратной связи. У человека этот механизм отсутствует. Поэтому при употреблении пищи богатой жирами, холестерин в крови резко возрастает, что может привести к образованию желчных камней и к заболеваниям сердечнососудистой системы.
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ
Белки – это высокомолекулярные гетерополимеры, мономерами которых являются аминокислоты, связанные пептидными связями. В различных объектах живой природы обнаружено около 200 аминокислот, однако только 20 из них входят в состав белков. Их называют основными, или белок образующими (протеиногенными). Основные аминокислоты разделяют на заменимые (синтезируются в самом организме) и незаменимые, которые организм получает из пищи. Некоторые аминокислоты (аргинин, гистидин) являются незаменимыми для детей, но синтезируются в организме взрослого человека.
Общее строение аминокислоты можно представить следующим образом:

Как видно из формулы, каждая аминокислота состоит из группы -NH2, которая называется аминогруппой и обладает основными свойствами, и группы –СООН, которая называется карбоксильной и имеет кислотные свойства. Аминокислоты отличаются друг от друга своими радикалами (R), которыми могут быть самые различные соединения.
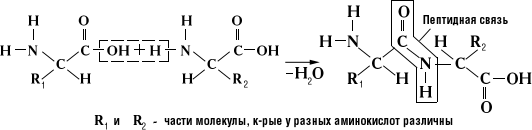
Аминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты, в результате чего выделяется вода, а аминокислоты соединяются между собой ковалентной – пептидной связью
O H
|| |
 (-С-N-)
(-С-N-)
Схема образования пептидной связи
Соединения двух аминокислот называют дипептидом, трех – трипептидом, из 20 и более аминокислотных остатков – полипептидом.
| Свойства и функции белков обусловлены последовательностью соединения аминокислот и пространственной структурой полипептидной цепи |
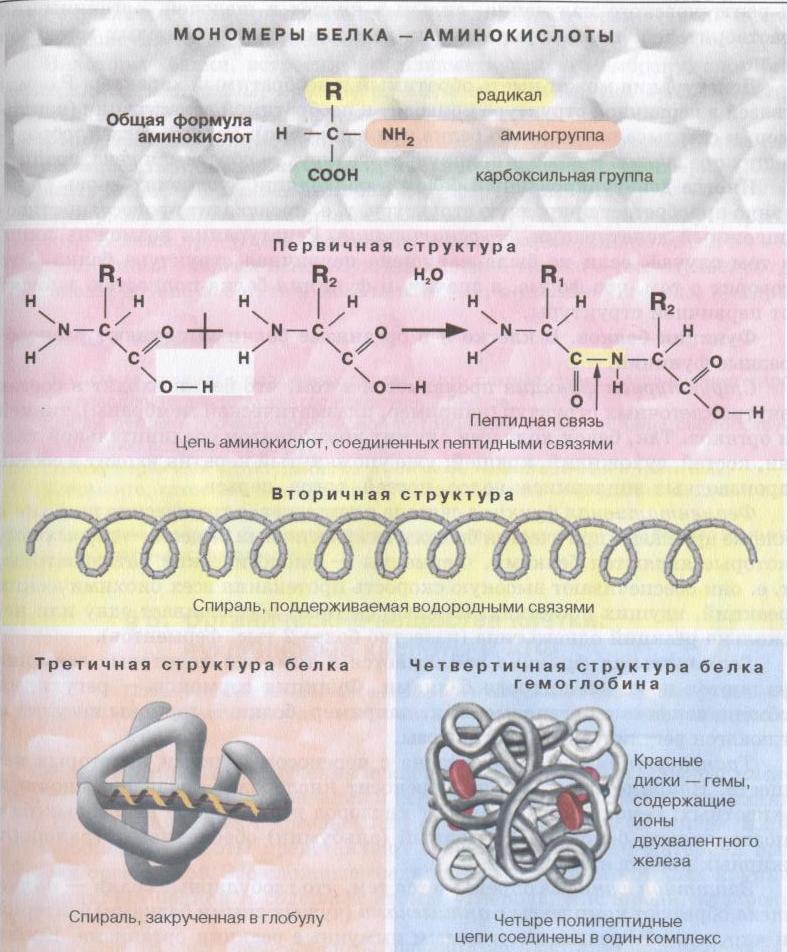
Рис.4.3. Уровни структурной организации белковой молекулы:
1-первичный;2- вторичный; 3- третичный; 4 –четвертичный.
Первичная структура закодирована в ДНК и определяется последовательностью, видом и количеством аминокислот в полипептидной цепи.
Вторичная структура. Как правило это α-спираль напоминающая растянутую пружину, которая удерживается множеством водородных связей, возникающих внутри одной полипептидной цепи. Другой тип вторичной структуры – это β-слой, или складчатый слой, который образует две параллельные полипептидные цепи, связанные водородными связями.
Полностью α-спиральную конфигурацию имеют белки кератина из которых состоят волоссы, ногти, когти, роги, копыта, клюв. Для других белков (например, белков шелка) характерны β-складчастые слои.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – фибриноген, актин, миозин и коллаген.
Третичная структура белковой молекулы – это пространственное трехмерное образование, напоминающее глобулу. Она образуется вследствие закручивания полипептидной спирали в трехмерное образование шаровидной формы – глобулу. Третичная структура белков поддерживается ковалентными, дисульфидными (S=S), ионными, водородными связями, а также гидрофобными взаимодействиями. Глобулярную структуру имеют большинство белков (альбумины, глобулины и др.)
Четвертичная структура представляет собой комплексное соединение из нескольких глобулярных белковых молекул, которые в совокупности составляют единую функциональную единицу.
Так, например, молекула гемоглобина состоит из четырех белковых субъединиц и небелковой части – гема, содержащего Ферум.
Устойчивость четвертичной структуры определяется водородными и электростатичными связями, гидрофобными взаимодействиями.
В последние годы была сформулирована теория доменной структуры белка. Доменом называют часть пептидной цепи, образующей как бы самостоятельную глобулу, причем на одной пептидной цепи может быть два или больше доменов. Домены в одном белке могут быть одинаковыми или различными как по структуре, так и по функции.
Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка.
По своему химическому составу белки делятся на простые и сложные.
Простые белки (протеины) состоят только из аминокислот (например, альбумины, глобулины сыворотки крови).
Сложные белки (протеиды) имеют в своем составе, кроме аминокислот, соединения небелковой природы – так называемую простетическую группу.
Сложными белками являются:
1. Нуклеопротеиды хромосом – белки связанные с нуклеиновыми кислотами;
2. Металлопротеиды – белки связанные с металлами (большинство ферментов);
3. Липопротеиды – белки, содержащие липиды (входят в состав мембран);
4. Гликопротеиды – белки в соединении с углеводами (некоторые гормоны, антитела);
5. Фосфолипиды – белки содержащие остатки фосфорной кислоты (белки казеин молока, яичного желтка).
Под влиянием высокой температуры, ионизирующего излучения, кислот, спирта, щелочей, тяжелых металлов и других факторов происходит нарушение вторичной, третичной и четвертичной структуры белка вследствие разрыва водородных и ионных связей.
Процесс нарушения нативной (естественной) структуре белка без разрушения пептидных связей называется денатурацией. В некоторых случаях после прекращения неблагоприятного действия факторов среды на белок его структура восстанавливается. Процесс восстановления денатурированной структуры белка называется ренатурацией.
Разрушение первичной структуры белка, вследствие разрыва пептидных связей всегда носит необратимый характер и называется деградацией.
Изменение структуры белка происходит и в естественных условиях. При выполнении ими многих жизненно-важных функций (ферментативной, регуляторной, сигнальной и др.)
Белки выполняют следующие функции:
1. Строительная (структурная). Белки входят в состав мембран и органоидов клетки, а также в состав вне клеточных структур (например, коллаген соединительной ткани);
2. Ферментативная (каталитическая). Каталитическую функцию выполняют белки-ферменты, ускоряющие в десятки и тысячи раз течение биохимических реакций. Действие ферментов строго специфично: каждый фермент катализирует только одну реакцию, действует только на одно вещество (один тип связи). Активность ферментов зависит от температуры, pH среды и других факторов;
3. Транспортная. Транспортные белки переносят различные вещества, например, гемоглобин переносит О2 и СО2, альбумины крови – жирные кислоты, глобулины – ионы металлов и гормоны. Белки плазматических мембран принимают участие в транспорте веществ в клетку.
4. Защитная. Белки образуют антитела и антигены иммунной системы, белок фибриноген и тромбин участвуют в свертывании крови и предотвращают кровотечение.
5. Двигательная. Актин и миозин обеспечивают сокращение мышц, тубулин – движение ресничек и жгутиков;
6. Регуляторная. Многие гормоны, регулирующие обменные процессы имеют белковую природу (например, инсулин, глюкагон);
7. Энергетическая. При окислении 1г белка освобождается 17,6 кДж энергии.
8. Сигнальная (рецепторная). Белки плазматических мембран при контакте с определенным веществом изменяют свою структуру и передают сигнал в соответствующий компартмент клетки;
9. Запасающая. Белок яйца, альбумин, белки эндосперма семян являются резервными и используются на ранних этапах развития организма.
Дата публикования: 2014-09-25; Прочитано: 5408 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
