 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Устойчивость комплексного иона
|
|
Комплексные ионы различных комплексных соединений по степени своей прочности и стойкости значительно отличаются друг от друга. Одни из них характеризуется высокой прочностью, практически не диссоциируют в водных растворах, некоторые не разрушаются даже под действием сильных реагентов и длительном нагревании. К стойким комплексным ионам относятся, например: [Рt(NН3)6]4+, [Fe(CN)6]3+, [Fe(CN)6]4+. Поэтому в растворах комплексных солей, содержащих указанные ионы, не удается определить наличие ионов Pt4+, Fe2+, Fe3+, CN–, используя обычные реактивы, применяемые при химическом анализе
Другие комплексные ионы менее устойчивы. Например, ион [Ag(CN)2]– в комплексной соли К[Ag(CN)2] в водных растворах диссоциирует, хотя и в малой степени, по уравнению:
[Ag(CN)2]– ←→ Ag+ + 2CN–.
Поэтому ион Ag + можно обнаружить с помощью чувствительных реактивов на ион серебра. Еще менее устойчив комплексный ион [Ag(NН3)2]+ с атомом серебра в качестве комплексообразователя, он в еще большей степени подвергается диссоциации в водных растворах.
Диссоциация комплексных ионов, подобно диссоциации молекул обычных электролитов, является процессом обратимым и подчиняется закону действия масс. Процесс характеризуется соответствующей константой диссоциации, которую в данном случае называют константой нестойкости и обозначают К н.:
 ,
,
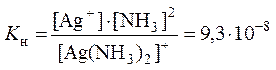 .
.
Чем меньше константа нестойкости комплексного иона, тем более устойчив комплексный ион, что можно видеть из данных табл. 1.
1 Таблица
Примеры комплексных соединений. Константы нестойкости
комплексных ионов
| Комплексное соединение | Комплексообразователь | Координационное число | Степень окисления комплексообразователя | Комплексный ион. | Заряд комплексного иона | Константа нестойкости комплексного иона |
| K[Ag(CN)2] | Ag | +1 | [Ag(CN)2] | 1– | 8∙10–22 | |
| [Ag(NH3)2] Cl | Ag | +1 | [Ag(NH3)2] | 1+ | 9,3∙10–8 | |
| [Cu(NH3)4] SO4 | Cu | +2 | [Cu(NH3)4] | 2+ | 2,1∙10–13 | |
| K2[HgJ4] | Hg | +2 | [HgJ4] | 2– | 1,5∙10–30 | |
| K3[Fe(CN)6] | Fe | +3 | [Fe(CN)6] | 3– | 1∙10–31 | |
| K4[Fe(CN)6] | Fe | +2 | [Fe(CN)6] | 4– | 1∙10–24 |
Чрезвычайно малая величина К н для комплексного иона [Fe(CN)6]3– указывает на то, что связи между ионом Fe3+ и ионами CN– очень прочны, они являются неионогенными, поэтому при растворении соли не удается обнаружить наличие свободного иона Fe3+ с помощью качественных реакций.
В этом проявляется отличие комплексных соединений от так называемых двойных солей. Последние представляют соли, образованные двумя металлами и одной кислотой, они могут образоваться, например, при кристаллизации из раствора, содержащего две соли. Например, если в растворе содержался сульфат калия К2SО4 и сульфат алюминия Al2(SO4)3 , то при кристаллизации образуется двойная соль* КAl(SО4)2·12Н2О. При растворении двойные соли диссоциируют на те же ионы, из которых они образовались:
КА1(SO4) 2 ←→ К+ + Al3+ + 2SO42–,
поэтому можно с помощью качественных реакций убедиться, что в растворе присутствуют самостоятельные ионы Al3+ и SO42–.
Дата публикования: 2014-11-18; Прочитано: 4621 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
