 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Коррозия металлов
|
|
При решении задач этого раздела см. табл. 8.
Коррозией называютсамопроизвольное разрушение металлических материалов под действиемокружающей среды. Как любой самопроизвольный процесс, коррозия сопровождается уменьшением энергии Гиббса (∆G < 0).
По механизму протекания различают химическую и электрохимическую коррозию. Химическая коррозия – окисление металлов и сплавов агрессивными веществами при отсутствии электролита, обычно при высоких температурах. Намного чаще приходится сталкиваться с электрохимической коррозией, протекающей в атмосферных условиях в присутствии электролита.
Разрушение металла при электрохимической коррозии происходит в результате работы огромного количества микрогальванических элементов, которые образуются на поверхности металла вследствие его энергетической неоднородности. Участки металла, имеющие более отрицательные значения потенциала, становятся анодами коррозионных микрогальванических элементов. Именно на этих участках протекает анодное окисление металла и происходит коррозионное разрушение.
Запись схемы электрохимической коррозии:
_





А (-) Анод│коррозионная среда (деполяризатор)│ Катод (+) К 
Таким образом, при электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный —окисление металла
A: (-) Me – ne = Men+;
катодный – восстановление окислителя, находящегося в окружающей среде,
K: (+) Ox + ne = Red.
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе — деполяризатором является кислород. В этом случае процесс называют коррозией с кислородной деполяризацией:
A: (-) Me – ne = Men+; (1)
К: (+) О2 + 2 Н2О + 4е = 4 ОН  (рН ≥ 7); φ0 = 1,23 В; (2)
(рН ≥ 7); φ0 = 1,23 В; (2)
О2 +4 Н+ + 4е = 2 Н2О (рН < 7). φ0 = 0,40 В. (3)
В водных растворах кислот в роли окислителя выступают ионы водорода Н+. Процесс называют коррозией с водородной деполяризацией:
A: (-) Me – ne = Men+;
К: (+) 2 Н+ + 2е = Н2 (рН << 7) φ0 = 0,00 В. (4)
Встречаются также процессы коррозии со смешанной кислородно-водородной деполяризацией, когда окислителями являются одновременно кислород О2 и ионы водорода Н+.
Появившиеся на анодных участках электроны по поверхности металла перетекают к катодным участкам, где принимаются окислителем (деполяризатором). Возникает коррозионный электрический ток. Поскольку анодные и катодные участки являются короткозамкнутыми, то для работы таких микрогальванопар достаточно тончайшей пленки влаги, конденсирующейся на поверхности металла в атмосферных условиях.
Особенно часто электрохимическая коррозия возникает при непосредственном контакте двух различных металлов (контактная коррозия), при частичном погружении в водный раствор (коррозия по ватерлинии), при использовании неудачных конструкций (щелевая коррозия).
Термодинамическая возможность коррозии определяется из условия
∆G < 0. Так как ∆G = — nFE и Е = φК – φА, то коррозия возможна, если
φА < φK, т.е. если электродный потенциал металла меньше электродного потенциала деполяризатора (см. уравнения (2) – (4)).
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием, в нейтральном и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Схема коррозионного процесса:
а) в кислой среде б) в нейтральной среде









А (-) Zn│ Н+ │ Cd (+) К  А (-) Zn│H2O; O2│ Cd (+) К
А (-) Zn│H2O; O2│ Cd (+) К
Анодный процесс протекает на поверхности цинка
А (-): Zn°-2e=Zn2+;
катодный процесс протекает на поверхности кадмия.
К (+): в кислой среде 2Н+ + 2е = H2;
в нейтральной среде  О2 + Н2О + 2e = 2ОH
О2 + Н2О + 2e = 2ОH  .
.
Так как ионы Zn2+с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2
Zn2+ + 2ОH  = Zn(OH)2.
= Zn(OH)2.
Пример 2. Составьте уравнения процессов, протекающих при коррозии стали, во влажной среде, содержащей кислород, при рН = 5. Как изменяются процессы в случае применения протекторной защиты?
Решение. Составим схему коррозионного процесса.





А (-) Fe│ O2; Н+ │ Fe (+) К
На анодных участках поверхности стали происходит окисление:
А (-): Fe°-2e = Fe2+. φ0 = - 0,440 В.
На катодных участках при рН = 5 возможно протекание процессов:
К (+): О2 +4 Н+ + 4е = 2 Н2О; (1)
2 Н+ + 2е = Н2. (2)
При рН = 5 вычислим электродные потенциалы катодных процессов:
для процесса восстановления кислорода (1)
φ1 = φ0 – 0,059 рН = 0,40 – 0,059 ∙ 5 = 0,105 В;
для процесса восстановления ионов Н+ (2)
φ2 = φ0 = 0,000 — 0,059 ∙ 5 = - 0,295 В.
Так как φ1 > φ2, протекает коррозия с кислородной деполяризацией (1).
Для протекторной защиты необходимо выбрать металл, потенциал которого более отрицательный, чем потенциал железа (табл. 8), например, магний. В этом случае анодом станет магний.
Анодный процесс
А (-): Mg°-2e = Mg2+.
Катодный процесс не изменится.
К (+): О2 +4 Н+ + 4е = 2 Н2О.
Пример 3. При атмосферной коррозии железного изделия после удаления слоя ржавчины было установлено, что потеря массы металла за 3 месяца работы составила 0,112 г. Вычислите объем кислорода, израсходованного на коррозию и величину коррозионного тока.
Решение. Составим схему коррозионного процесса.




А (-) Fe│ O2; Н2О │ Fe (+) К 
Запишем уравнения анодного и катодного процессов коррозии:
А (-): Fe°-2e = Fe2+
К (+):  О2 + Н2О + 2e = 2ОH
О2 + Н2О + 2e = 2ОH 
Fe2+ + 2ОH  = Fe(OH)2
= Fe(OH)2
Fe(OH)2 +  О2 + Н2О = Fe(OH)3.
О2 + Н2О = Fe(OH)3.
Рассчитаем nэ - число молярных масс эквивалента (число моль-экв.) железа, растворившегося в результате процесса анодного окисления:
nэ = 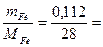 0,004 моль.
0,004 моль.
Согласно второму закону Фарадея, столько же эквивалентов кислорода должно быть израсходовано в катодном процессе. Следовательно, объем кислорода, израсходованного на коррозию:
 0,0224 л = 22,4 мл.
0,0224 л = 22,4 мл.
Величину коррозионного тока определяем по закону Фарадея:

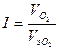
 4,96∙10-5 А.
4,96∙10-5 А.
КОНТРОЛЬНЫЕ ВОПРОСЫ
281. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
282. Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
283. На железную пластинку массой 3 г нанесено никелевое покрытие. Механическое повреждение покрытия привело к атмосферной коррозии и возникновению коррозионного тока I = 2∙10-4 A. Определите массу прокорродировавшего за два месяца металла. Составьте электронные уравнения анодного и катодного процессов.
284. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
285. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
286. Железное изделие покрыли никелем. Какое это покрытие: анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
287. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний — никель. Какие продукты коррозии образуются в первом и во втором случаях?
288. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
289. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
290. Какое покрытие металла называется анодным и какое — катодным? Назовите несколько металлов, которые могут применяться для анодного и катодного покрытий железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
291. Железное изделие покрыли кадмием. Какое это покрытие: анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
292. Железное изделие покрыли свинцом. Какое это покрытие: анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
293. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
294. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, медь или висмут? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
295. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Но если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
296. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
297. Олово опаяно серебром. Составьте электронные уравнения анодного и катодного процессов коррозии при попадании этой пары металлов в щелочную среду с рН = 9. Рассчитайте электродные потенциалы всех возможных катодных процессов при заданном значении рН и обоснуйте выбор деполяризатора.
298. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
299. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией.
300. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Дата публикования: 2014-11-18; Прочитано: 22105 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
