 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
На аноде в первую очередь идут реакции окисления с наименьшим электродным потенциалом
|
|
Возможные анодные реакции:
1) окисление анионов А 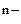 - ne = A0;
- ne = A0;
2) окисление молекул воды
2 Н2О – 4е = О2 + 4 Н+ j 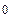 = 1,23 В;
= 1,23 В;
3) окисление ионов ОН  при рН >>7
при рН >>7
4ОН  - 4е = О2 + 2 Н2О j
- 4е = О2 + 2 Н2О j 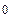 = 0,401 В;
= 0,401 В;
4) окисление растворимого анода, т. е. металла, из которого изготовлен анод Me - ne = Men+
К нерастворимым электродам относятся аноды из золота, платины, графита, нержавеющей стали и некоторых др. материалов. Аноды из большинства металлов являются растворимыми.
При рассмотрении анодных процессов полезно запомнить несколько простых правил.
· На инертном аноде в первую очередь окисляются анионы беcкислородных кислот, кроме аниона F  (пункт 1):
(пункт 1):
S2  - 2е = S0 j
- 2е = S0 j 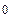 = - 0,447 В;
= - 0,447 В;
2 I  - 2е = I2 j
- 2е = I2 j 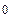 = 0,54 В;
= 0,54 В;
2 Br  -2е = Br2 j
-2е = Br2 j 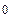 = 1,1 В;
= 1,1 В;
2 Cl  -2е = Cl2 j
-2е = Cl2 j 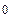 = 1,36 В.
= 1,36 В.
Следует отметить, что стандартный потенциал окисления ионов хлора несколько больше, чем у молекул воды. Но окисление молекул воды осложняется высоким перенапряжением кислорода (достигает до 1,6 В). Поэтому процесс окисления ионов Cl  протекает легче, чем окисление воды.
протекает легче, чем окисление воды.
Во вторую очередь происходит окисление анионов ОН  из щелочных растворов (пункт 3). Анионы кислородсодержащих кислот (SO
из щелочных растворов (пункт 3). Анионы кислородсодержащих кислот (SO  , NO
, NO  , CO
, CO  и др.), а также анион F
и др.), а также анион F  из водных растворов не окисляются, так как процесс окисления воды имеет меньший потенциал, даже с учетом кислородного перенапряжения (пункт 2).
из водных растворов не окисляются, так как процесс окисления воды имеет меньший потенциал, даже с учетом кислородного перенапряжения (пункт 2).
· При электролизе с растворимым анодом происходит анодное окисление анода (пункт 4).
Пример 1. Составьте электронные уравнения процессов, протекающих при электролизе раствора хлорида висмута: а) с графитовым анодом; б) с анодом из металла – висмута.
Решение. Уравнение диссоциации: BiCl3 ó Bi3+ + 3 Cl  .
.
Выписываем ионы и молекулы, находящиеся у поверхности анода и катода, а также значения электродных потенциалов соответствующих процессов.
а)Электролиз с графитовым анодом:
(-) Катод (+)Анод
Bi3+, j° = 0,215 B; Cl  , j° = 1,36 B; H2O, j° = - 0,83 B. H2O, j° = 1,23 B
, j° = 1,36 B; H2O, j° = - 0,83 B. H2O, j° = 1,23 B
Выбираем катодный процесс с наибольшим потенциалом и анодный процесс с наименьшим потенциалом, учитывая кислородное перенапряжение при окислении молекул воды:
К (-): Bi3+ + 3e → Bi0 x 2 А (+): 2 Cl  - 2e → Cl2 x3
- 2e → Cl2 x3
Молекулярное уравнение электролиза:
2 BiCl3 + H2O → 2 Bi + 3 Cl2 + H2O
б) Электролиз с анодом из висмута:
(-) Катод (+)Анод
Bi3+, j° = 0,215 B; Cl  , j° = 1,36 B; H2O, j° = - 0,83 B. H2O, j° = 1,23 B;
, j° = 1,36 B; H2O, j° = - 0,83 B. H2O, j° = 1,23 B;
Bi3+, j° = 0,215 B.
Bi3+ + 3e → Bi0 Bi0 - 3e → Bi3+
Пример 2. Какая масса меди выделится на катоде при электролизе раствора CuS04 в течение 1 часа при силе тока 4 А?
Решение. Согласно законам Фарадея
 , (1)
, (1)
где т — масса вещества, окисленного или восстановленного на электроде;
mЭ — молярная масса эквивалента вещества;
I — сила тока, А;
t — продолжительность электролиза, с.
Молярная масса эквивалента меди mЭ =  = 31,77 г/моль. Подставив в формулу (1) значения mЭ = 31,77 г/моль, 1=4 А, t= 60∙60 = = 3600 с, получим
= 31,77 г/моль. Подставив в формулу (1) значения mЭ = 31,77 г/моль, 1=4 А, t= 60∙60 = = 3600 с, получим
 г.
г.
Пример 3. Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Подставляя в формулу (1) численные значения, получаем
mЭ = 11,742 ∙ 96500/3880 = 29,35 г/моль,
где m = 11,742 г; I∙t = Q = 3880 Кл.
Пример 4. Чему равна сила тока при электролизе раствора в течение
1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1)

Так как дан объем водорода, то отношение т/mЭ заменяем отношением  , где
, где  — объем водорода, л.;
— объем водорода, л.;  — объем молярной массы эквивалента водорода, л. Тогда
— объем молярной массы эквивалента водорода, л. Тогда

Объем молярной массы эквивалента водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения  = 1,4 л,
= 1,4 л,  = 11,2 л, t = 6025 c (1 час 40 мин. 25 с. = 6025 с), находим
= 11,2 л, t = 6025 c (1 час 40 мин. 25 с. = 6025 с), находим

Пример 5. Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SО4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Объем молярной массы эквивалента кислорода (н.у.):
22,4/4 = = 5,6 л. Следовательно, 11,2 л содержат две молярные массы эквивалента кислорода. Столько же молярных масс эквивалента КОН образовалось у катода. Отсюда: 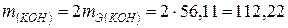 г. (56,11 г/моль — молярная масса и молярная масса эквивалента КОН).
г. (56,11 г/моль — молярная масса и молярная масса эквивалента КОН).
КОНТРОЛЬНЫЕ ВОПРОСЫ
261. Электролиз раствора К2SO4 проводили при силе тока 5 А в течение 3 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
Ответ: 5,03 r; 6,266 л; 3,133 л.
262. При электролизе соли некоторого металла в течение 1,5 ч при силе тока 1,8 А на катоде выделилось 1,75 г этого металла. Вычислите эквивалентную массу металла.
Ответ: 17,37 г/моль.
263. При электролизе раствора CuSO4 на аноде выделилось 168 см3 газа (н.у.). Составьте электронные уравнения процессов, происходящих на электродах, и вычислите, какая масса меди выделилась на катоде.
Ответ: 0,953 г.
264. Электролиз раствора Na2SO4 проводили в течение 5 ч при силе тока 7 А. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса воды при этом разложилась и чему равен объем газов (н.у.), выделившихся на катоде и аноде?
Ответ: 11,75 г; 14,62 л; 7,31 л.
265. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течение 4 ч. Составьте электронные уравнения процессов, происходящих на электродах. Какая масса серебра выделилась на катоде и каков объем газа (н.у.), выделившегося на аноде?
Ответ: 32,20 г; 1,67 л.
266. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите эквивалентную массу металла.
Ответ: 32,7 г/моль.
267. На сколько уменьшится масса серебряного анода, если электролиз раствора AgNO3 проводить при силе тока 2 А в течение 38 мин 20 с? Составьте электронные уравнения процессов, происходящих на графитовых электродах.
Ответ: 5,14 г.
268. Электролиз раствора сульфата цинка проводили в течение
5 ч, в результате чего выделилось 6 л кислорода (н.у.). Составьте уравнения электродных процессов и вычислите силу тока.
Ответ: 5,74 А.
269. При электролизе раствора CuSО4 с медным анодом в течение 4 ч при силе тока 50 А было получено 224 г меди. Вычислите выход по току. Составьте электронные уравнения процессов, протекающих на электродах в случае: а) медного анода; б) угольного анода.
Ответ: 94,48%.
270. Электролиз раствора NaI проводили при силе тока 6 А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде?
Ответ: 0,56 г; 71,0 г.
271. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора AgNO3. Определите расход электричества, если при проведении электролиза с серебряным анодом его масса уменьшается на 5,4 г.
Ответ: 4830 Кл.
272. Электролиз раствора CuSО4 проводили в течение 15 мин при силе тока 2,5 А. Выделилось 0,72 г меди. Составьте электронные уравнения процессов, протекающих на электродах в случае медного и угольного анодов. Вычислите выход по току.
Ответ: 97,3%.
273. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе расплавов и водных растворов NaCl и КОН. Сколько литров (н.у.) газа выделится на аноде при электролизе гидроксида калия, если электролиз проводить в течение 30 мин при силе тока 0,5 А?
Ответ: 0,052 л.
274. Составьте электронные уравнения процессов, происходящих на графитовых электродах при электролизе раствора КВг. Какая масса вещества выделяется на катоде и аноде, если электролиз проводить в течение 1 ч 35 мин при силе тока 15 А?
Ответ: 0,886 г; 70,79 г.
275. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора CuCl2. Вычислите массу меди, выделившейся на катоде, если на аноде выделилось 560 мл газа (н.у.).
Ответ: 1,588 г.
276. При электролизе соли трехвалентного металла при силе тока 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла.
Ответ: 114,82.
277. При электролизе растворов MgSO4 и ZnCI2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах?
Ответ: 8,17 г; 2,0 г; 8,86 г.
278. Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SО4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.). Какая масса H2SO4 образуется при этом возле анода?
Ответ: 0,2 г; 9,8 г.
279. При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна молярная масса эквивалента кадмия?
Ответ: 56,26 г/моль.
280. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у.) выделилось при этом на катоде?
Ответ: 17,08 А; 8,96л.
Дата публикования: 2014-11-18; Прочитано: 4818 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
