 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ионно-молекулярные (ионные) реакции обмена
|
|
При решении задач этого раздела см. табл. 9 и прилож. 2.
Ионно-молекулярные, или ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества, записывают в молекулярной форме.
В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения.
Пример 1. Напишите ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ:
а) НС1 и NaOH; б) Рb(NO3)2 и Na2S; в) NaCIO и НNО3; г) К2СОз и H2SО4; д) СНзСООН и NaOH.
Решение. Запишем уравнения взаимодействия указанных веществ в молекулярном виде
а) НС1 + NaOH = NaCI + H2O;
б) Pb(NО3)2 + Na2S = PbS + 2 NaNО3;
в) NaCIO + HNО3 = NaNО3 +HC1О;
г) К2СОз + Н2S04 = К2SО4 + СО2 + Н2О;
д) СН3СООН + NaOH = CH3COONa + Н2О.
Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов (Н2О, HC10), осадка (PbS), газа (СО2).
В реакции (д) два слабых электролита, но так как реакции идут в сторону большего связывания ионов и вода — более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства:
а) Na+ и Сl-; б) Na+ и NO  ; в) Na+ и NO
; в) Na+ и NO  3; г) К+ и SO
3; г) К+ и SO  ; д) Na+,
; д) Na+,
получим ионно-молекулярные уравнения этих реакций:
а) H+ + ОН  = Н2О;
= Н2О;
в) Pb2+ + S  = PbS;
= PbS;
б) С1О  + H+ = HC1О;
+ H+ = HC1О;
г) СО  +2 H+ = CО2+H2О;
+2 H+ = CО2+H2О;
д) СНзСООН + ОН  = СНзСОО
= СНзСОО  + Н2О.
+ Н2О.
Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
а) SO  +2 H+ = S02 + H2О;
+2 H+ = S02 + H2О;
б) Pb2+ + CrО  = PbCr04;
= PbCr04;
в) НСО  + ОН
+ ОН  = СО
= СО  + Н2О;
+ Н2О;
г) ZnOH+ + H+ = Zn2+ + H2O.
Решение. В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов. Cледовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
а) Na2SО3 + 2 НС1 = 2 NaCl + SO2 + Н2О;
б) Pb(NO3)2 + K2CrO4 = PbCrO4 + 2 KNO3;
в) КНСО3 + КОН = К2СО3 + H2O;
г) ZnOHCl + НС1 = ZnCl2 + H2O.
КОНТРОЛЬНЫЕ ВОПРОСЫ
161. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NаНСОз и NaOH;
б) K2SiO3 и НС1; в) BaCl2 и Na2SO4.
162. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) K2S и НС1;
б) FeSО4 и (NH4)2S; в) Сг(ОН)3 и КОН.
163. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Mg2+ + CO  = MgCО3; б) H+ + ОН
= MgCО3; б) H+ + ОН  = H2O.
= H2O.
164. Какие из веществ - А1(ОН)3; H2SО4; Ва(ОН)2 - взаимодействуют с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
165. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и H2SО4;
б) Zn(OH)2 и NaOH; в) СаСl2 и AgNО3.
166. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CuSО4 и H2S;
б) ВаСО3 и HNO3; в) FеС13 и КОН.
167. Составьте по три молекулярных уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
а) Си2+ + S  = CuS;
= CuS;
6) SiO  + 2 H+ = H2SiO3.
+ 2 H+ = H2SiO3.
168. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Sn(OH)2 и НС1;
б) BeSО4 и КОН; в) NH4Cl и Ва(ОН)2.
169. Какие из веществ — КНСО3, СН3СООН, NiS04, Na2S — взаимодействуют с раствором серной кислоты? Напишите молекулярные и ионно-молекулярные уравнения этих реакций.
170. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) AgNО3 и К2СrO4;
б) Pb(NО3)2 и KI; в) CdSО4 и Na2S.
171. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) СаСО3 + 2 Н+ = Са2+ + H2O + CO2;
б) А1(ОН)3 + ОН  = А1O
= А1O  + 2 Н2О;
+ 2 Н2О;
в) РЬ2+ + 2 I  = PbI2
= PbI2
172. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Ве(ОН)2 и NaOH; б) Си(ОН)2; и HNО3; в) ZnOHNО3 и HNО3.
173. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) Na3PО4 и CaCl2;
б) К2СО3 и ВаСl2; в) Zn(OH)2 и КОН.
174. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
Fе(ОН)3 + З H+ = Fe3+ + З Н2О;
Cd2+ + 2 OН  = Cd(OH)2;
= Cd(OH)2;
H+ + NO  = HNO2.
= HNO2.
175. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) CdS и НС1;
б) Сг(ОН)3 и NaOH; в) Ba(OH)2 и CoCl2.
176. Составьте молекулярные и ионно-молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn2+ + H2S = ZnS + 2 H+;
б) НСО  + Н+ = H2O + СО2;
+ Н+ = H2O + СО2;
в) Ag+ + С1  = AgCl.
= AgCl.
177. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2S04 и Ва(ОН)2;
б) FеС13 и NH40H; в) CH3COONa и НС1.
178. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FеС13 и КОН;
6) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
179. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Ве(ОН)2 + 2 OН  = ВеО
= ВеО  + 2 Н2O
+ 2 Н2O
б) СНзСОО  + Н+ = СНзСООН
+ Н+ = СНзСООН
в)Ba2+ + SO  = BaSO4
= BaSO4
180. Какие из веществ — NaCl, NiS04, Ве(ОН)2, КНСОз — взаимодействуют с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
10. ИОННОЕ РАВНОВЕСИЕ ВОДЫ.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ рН
Вода является очень слабым электролитом и лишь в незначительной степени диссоциирует на ионы водорода и гидроксила:
 Н2О Н+ + ОН
Н2О Н+ + ОН  .
.
Этому процессу соответствует константа диссоциации:
 . (1)
. (1)
Константа диссоциации воды очень мала (К Д.(Н 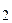 О) = 1,86ּ10
О) = 1,86ּ10  ), поэтому равновесная концентрация недиссоциированных молекул воды практически равна общей концентрации воды:
), поэтому равновесная концентрация недиссоциированных молекул воды практически равна общей концентрации воды:
[H2O] = СМ =  моль/л.
моль/л.
В разбавленных водных растворах концентрация воды меняется незначительно, так что ее можно считать постоянной. Тогда из формулы (1) получим
[H+]ּ[OH  ] = К Д.ּ[H2O] = 1,86ּ10
] = К Д.ּ[H2O] = 1,86ּ10  ּ55,56 = 10
ּ55,56 = 10  .
.
Таким образом, произведение концентраций ионов водорода и гидроксила представляет собой постоянную величину (при данной температуре) и называется ионным произведением воды КН 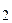 O. При стандартной температуре Т = 298К (250С)
O. При стандартной температуре Т = 298К (250С)
КН 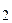 O = [H+]ּ[OH
O = [H+]ּ[OH  ] = 10
] = 10  . (2)
. (2)


 В нейтральных растворах [H+] =ּ[OH
В нейтральных растворах [H+] =ּ[OH  ] = Ö 10
] = Ö 10  = 10
= 10  моль/л.
моль/л.
Для характеристики кислотности (щелочности) среды используется водородный показатель рН – десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
рН = - lg [H+].
В нейтральных растворах рН = 7. В кислых растворах [H+] > 10  , следовательно, рН < 7; в щелочных растворах [H+] < 10
, следовательно, рН < 7; в щелочных растворах [H+] < 10  , поэтому рН > 7.
, поэтому рН > 7.
По аналогии с водородным показателем рН введен показатель рОН.
рОН = - lg [OH  ].
].
Логарифмируя соотношение (2), получим рН + рОН = 14.
Пример 1. Определить концентрацию ионов водорода в растворе, если рН = 4,60.
Решение. По условию задачи рН = 4,60 = -lg [H+].
Отсюда [H+] = 10-4,60 = 2,5.10-5 моль/л.
Пример 2. Определть концентрацию ионов [OH  ] в растворе, если рН = 10,80.
] в растворе, если рН = 10,80.
Решение. Из соотношения рН + рОН = 14 находим
ОН = 14 – 10,80 = 3,20.
Отсюда –lg [OH  ] = 3,20. Следовательно [OH
] = 3,20. Следовательно [OH  ] = 10-3,20 = 6,31.10-4.
] = 10-3,20 = 6,31.10-4.
Пример 3. Вычислить рН 0,01 М раствора гидроксида натрия.
Решение. Гидроксид натрия является сильным основанием, диссоциирует на ионы практически полностью
NaOH = Na+ + OH  .
.
Из уравнения диссоциации следует, что из одного моля гидроксида натрия образуется один моль ионов OH  ,следовательно в 0,01 М растворе [OH
,следовательно в 0,01 М растворе [OH  ] = 0,01. Найдем рОН = - lg [OH
] = 0,01. Найдем рОН = - lg [OH  ] = -lg 0,01 = 2.
] = -lg 0,01 = 2.
Отсюда рН = 14 – рОН = 12.
КОНТРОЛЬНЫЕ ВОПРОСЫ
181. Определите рН раствора, в 0,5 л которого содержится 0,05 г NaOH.
Ответ: 11;40.
182. Во сколько раз концентрация ионов водорода в крови (рН = 7,36) меньше, чем в желудочном соке (рН = 1,00)?
Ответ: В 2,3∙10  раз.
раз.
183. Определите [H+] и [OH  ] в растворе, рН которого равен 6,2.
] в растворе, рН которого равен 6,2.
Ответ: 6,3∙10  моль/л; 1,6∙10
моль/л; 1,6∙10  моль/л.
моль/л.
184. Рассчитайте рН раствора, полученного смешением 25 мл 0,5 М раствора HCl, 10мл 0,5 М раствора NaOH и 15 мл воды.
Ответ: 0,82.
185. Как изменится рН 0,2 М раствора HCl, если его вдвое разбавить водой?
Ответ: Увеличится на 0,3.
186. Вычислите рН 0,5%-ного раствора азотной кислоты.
Ответ: 1,10.
187. К 500 мл воды прибавили 20 мл 0,1 н раствора НС1. Найдите рН полученного раствора.
Ответ: 2,4.
188. Вычислите рН 1,5%-ного раствора КОН.
Ответ: 13,43.
189. 25 мл 10%-ного раствора HCl (плотность 1,05) разбавили водой до 500 мл. Вычислите рН полученного раствора.
Ответ: 0,84.
190. К 250 мл нейтрального раствора прибавили 50 мл 0,5 н раствора КОН. Вычислите рН полученного раствора.
Ответ: 12,9.
191. 10,0 мл 20%-ного раствора КОН (плотность 1,18) разбавили водой до 250 мл. Вычислите рН полученного раствора.
Ответ: 13,23.
192. В мерную колбу на 250 мл налили 10,0 мл 24%-ного раствора HCl (плотность 1,12) и довели раствор водой до метки. Из полученного раствора 5,0 мл перенесли в мерную колбу на 100 мл и разбавили водой до метки. Найдите рН полученного раствора.
Ответ: 1,83.
193. К 25 мл 0,2 н раствора HCl прибавили 25 мл 0,1 н раствора NaOH.Вычислите рН полученного раствора.
Ответ: 1,3.
194. 20,0 мл 12%-ного раствора NaOH (плотность 1,14) разбавили водой до 500 мл. 50,0 мл полученного раствора перенесли в другую колбу и разбавили водой до 1000 мл. Найдите рН последнего раствора.
Ответ: 11,85.
195. К 100 мл 0,1 н раствора HNO3 прибавили 2 мл 6%-ного раствора NaOH (плотность 1,0). Найдите рН полученного раствора.
Ответ: 1,2
196. Найдите рН раствора, в 100 мл которого содержится 0,12 мг NaOH.
Ответ: 9,48.
197. К 100 мл 0,1 н раствора NaOH прибавили 5 мл 4%-ного раствора HCl (плотность 1,0). Найдите рН исходного и полученного раствора.
Ответ: 13; 12,6.
198. К 100 мл 0,2 н раствора HCl прибавили 5 мл 3%-ного раствора КОН. Найдите рН исходного и полученного раствора.
Ответ: 0,7; 0,78.
199. Какую массу NaOH следует растворить в 400 мл воды, чтобы получить раствор, рН которого равен 12?
200. Вычислите молярную концентрацию раствора гидроксида бария, если известно, что рН данного раствора равен 11.
Дата публикования: 2014-11-18; Прочитано: 1354 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
