 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
РН – буферные системы
|
|
В природных водах, как правило, присутствуют одновременно кислоты и сопряженные им основания. Например, в большинстве водоемов одновременно растворен углекислый газ и сопряженное ему основание гидрокарбонат–ион. Такие системы способны поддерживать более или менее постоянное значение рН при внесении в них как сильных кислот (кислот, более сильных, чем растворенная кислота), так и сильных оснований (оснований, более сильных, чем растворенное основание) и называются рН –буферными системами.
Механизм буферного действия рН–буферной системы достаточно прост: она реагирует как с сильными кислотами, так и с сильными основаниями, превращая их в слабые. Например:
НСО3– + Н3O+ = 2Н2О + СО2;
Н2О + СО2 + В– = НСО3– + НВ.
Наличие в природных водах буферных систем — одно из важнейших условий существования жизни. Если бы буферных систем не было, продукты жизнедеятельности организмов легко превратили бы все природные воды в разбавленные кислоты. При различных рН кислота (основание) распределяется между протонированной (кислотной) и депротонированной (основной) формами. Чтобы рассчитать соотношение протонированной и депротонированной формы, можно воспользоваться уравнением:
lg([HA]/[A–]) = pKa –PH,
где рКа — отрицательный логарифм константы кислотности.
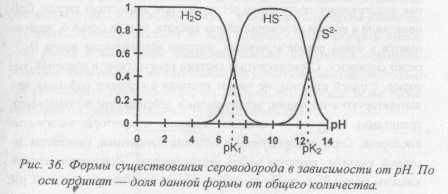
Как пример, на рисунке приведено распределение сероводорода по формам в зависимости от рН.
Добавление в буферную систему с определенным рН небольших количеств кислоты или основания приводит к распределению кислоты (основания) между протонированной и депротонированной формами. Для грубых оценок можно принять, что при рН<рKa преобладает кислота (протонированная форма), а при рН>рKa — сопряженное ей основание (депротонированная форма). Как видно из примера на рисунке, если сероводород (pKa (H2S)=7, pKa (HS–) = 12,3) попадает в буферную среду с рН<7, то он существует преимущественно в форме H2S, при 7<рН<12,3 — в форме HS–, при рН>12,3 — в форме S2–.
рН – буферная емкость любого раствора (в том числе и природной воды) ограничена: как только прореагирует все растворенное основание или растворенная кислота, рН уже не будет удерживаться. Отсюда вывод: чтобы в водоеме не происходило фатальных изменений, количество кислоты, которое в него попадает, должно быть меньше, чем его буферная емкость (обычно условие еще более жесткое: рН не может меняться более, чем на единицу).
Нужно также заметить, что буферными свойствами обладает не только вода, но и водоем в целом. Причем буферная емкость водоема может быть больше, чем буферная емкость содержащейся в нем воды, поскольку с кислотами и основаниями могут также реагировать вещества, содержащиеся во взвесях, донных отложениях и т.д.
Дата публикования: 2014-11-18; Прочитано: 503 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
