 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Щоб виконати роботу, Ви повинні знати! 1. Електроліз – це окисно-відновний процес, що протікає за умови пропускання постійного електричного струму через розплав або розчин електроліту
|
|
1. Електроліз – це окисно-відновний процес, що протікає за умови пропускання постійного електричного струму через розплав або розчин електроліту.
2. Анод – це електрод, на якому відбувається процес окиснення (тобто віддача електронів).
3. Катод – це електрод, на якому відбувається процес відновлення (тобто приєднання електронів).
4. Порядок окиснення йонів або атомів на аноді: в першу чергу окиснюються частинки з меншим значенням електродного потенціалу.
5. Порядок відновлення йонів або молекул на катоді: в першу чергу відновлюються частинки з більшим значенням
електродного потенціалу.
6. Закони Фарадея:
Перший закон Фарадея: маси речовин, що виділилися на електродах, прямопропорційні кількості електрики (Q),
яка пройшла через розчин або розплав електроліту.
m=k•Q
m – маса речовини, яка виділяється на електродах (г)
Q-кількість електрики, Q=I•t (Кл)
I-сила струму (А)
t-тривалість електролізу (с)
k-електрохімічний еквівалент 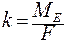
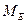 – молярна маса еквівалента (г/моль);
– молярна маса еквівалента (г/моль); 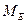 =M/B
=M/B
M – молярна маса (г/моль); B – валентність 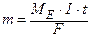 ;
; 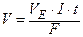 ;
; 
V – об'єм речовини (л)
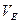 - еквівалентний об'єм (л/моль);
- еквівалентний об'єм (л/моль);
F – число Фарадея (96500 Кл/моль; 26,8 А·годину/моль)
Другий закон Фарадея: у разі проходження через різні електроліти однакової кількості електрики на електродах
виділяються маси речовин, пропорційні молярним масам їх еквівалентів. Хімічні еквіваленти
пропорційні електрохімічним.
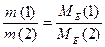
7. Вихід за струмом (h):

8. Гальваностегія - це нанесення за допомогою електролізу металевих покриттів з метою захисту від корозії, зміцнення поверхні,
декоративного, антифрикційного відновлення розмірів деталей тощо. Наприклад, покриття хромом, нікелем, цинком.
9. Гальванопластика - це процес отримання точних металевих копій з рельєфних предметів електроосадженням металу (на алюмінієву
форму наносять електролізом шар міді потрібної товщини, потім алюміній розчиняють в хлоридній кислоті або в
розчині лугу, з якими мідь не реагує).
10. Електролітичне рафінування. З чорнового металу виготовляють активні(розчинні) аноди, під час електролізу домішки, що присутні в
чорновому металі анода, випадають в осад у вигляді анодного шламу (Cu, Ni, Sn, Pb, Ag, Au), а чистий метал
виділяється на катоді.
Література:
[1] с. 84-90; [2] с. 240-257; [3] с. 198-204; [4] с. 192-195; [5] с. 168-174
Дайте відповіді на запитання:
| 1. Визначить поняття «Електроліз» | |
| 2. Визначить поняття «Анод» | |
| 3. Визначить поняття «Катод» | |
| 4. Що означає поняття «вихід за струмом»? | |
| 5. Який порядок відновлення йонів на катоді? | |
| 6. Який порядок окиснення йонів на аноді? | |
| 7. Чому в гальванічних елементах анод заряджений негативно, а під час електролізу – позитивно? | |
| 8. Чому електродний потенціал води на катоді складає -0.83В, а на аноді = +1.23В? |
Завдання для самостійної роботи
1. Електроліз розчину K2SO4 проводили струмом силою 5 А протягом 3 годин. Складіть електронні рівняння процесів, що протікають на електродах. Яка маса води при цьому розклалася і чому дорівнюють об'єми газів, що виділилися на катоді і аноді?
Відповіді: 5,03 г; 6,266 л; 3,133 л.
2. Під час електролізу солі деякого металу протягом 1,5 години струмом силою 1,8 А на катоді виділилося 1,75 г цього металу. Визначте молярну масу еквівалента металу. Назвіть цей метал (В=3). Відповідь: 17,37 г/моль.
3. Під час електролізу розчину CuSO4 на аноді виділилося 168 см3 газу (н.у.). Складіть електронні рівняння процесів, що відбуваються на електродах, та визначте, яка маса міді виділилася на катоді. Відповідь: 0,953 г.
5. Електроліз розчину Na2SO4 проводили протягом 5 годин струмом силою 7 А. Складіть електронні рівняння процесів, що відбуваються на електродах. Яка маса води розклалася, і чому дорівнюють об'єми газів (н.у.), що виділилися на катоді і аноді? Відповіді: 11,75 г; 14,62 л; 7,31л.
6. Виконайте роботу та заповніть лабораторний журнал:
Дотримуйтесь правил техніки безпеки!! (стор5)
| № | Зміст роботи | Рівняння реакцій, спостереження, розрахунки |
| Дослід 1 Електроліз розчину Натрій сульфату. У U-подібну трубку налийте розчин Натрій сульфату. Додайте у кожне коліно 2-3 краплі розчину лакмусу. Потім занурити в розчин графітові електроди. Включіть випрямляч струму і пропускайте струм протягом 5-10 хвилин. Складіть схему електролізу, рівняння електродних реакцій, визначте маси лугу, кислоти та об’єми газів, якщо I=6 A; t = 10 хвилин. | Рівняння дисоціації: Na2SO4  2Na+ +SO42-
Процеси: H2O
(-) K (+) A
Na+ ( 2Na+ +SO42-
Процеси: H2O
(-) K (+) A
Na+ (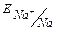 = -2.71B) SO42- ( = -2.71B) SO42- (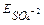 =2.01B)
H2O ( =2.01B)
H2O ( =-0.83В) H2O ( =-0.83В) H2O (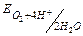 =+1.23В) =+1.23В)
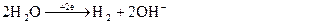 
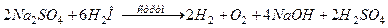    Розрахунки:
m(NaON)=
m(H2SO4)=
V(H2)=
V(O2)=
Розрахунки:
m(NaON)=
m(H2SO4)=
V(H2)=
V(O2)=
| |
| Дослід 2 Електроліз розчину Калій йодиду. Налийте в U - подібну трубку розчин Калій йодиду, та 3 краплі фенолфталеїну Проведіть електроліз з графітовими електродами. Визначте масу Калій йодиду при I=6 A; t = 10 хвилин. Як можно довести утворення йоду? | Рівняння дисоціації: Процеси: (-) К (+) А Розрахунки: | |
| Дослід 3 Електроліз розчину Купрум(П) хлориду.Налийте в електролізер розчин Купрум(П) хлориду та проведіть електроліз. Визначте масу речовини на катоді та об’єм газу на аноді (I=6 A; t = 10 хвил.), якщо вихід за струмом складає 70%. Додайте розчин KI. Що спостерігаєте? Напишіть рівняння реакції. | Рівняння дисоціації: Процеси: (-) К (+) А Розрахунки: | |
Дослід 4.
Електроліз розчину 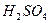 з мідним анодом. Залийте в U-подібну трубку розчин з мідним анодом. Залийте в U-подібну трубку розчин 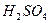 . Графітовий електрод приєднайте до катода, а мідний - до анода і проведіть електроліз. Складіть рівняння катодної та анодної реакцій. Поясніть і зробіть висновок про застосування такого методу електролізу.
Визначте масу або об’єм речовин, що виділяються на електродах (І=5А, t=5хвил.) . Графітовий електрод приєднайте до катода, а мідний - до анода і проведіть електроліз. Складіть рівняння катодної та анодної реакцій. Поясніть і зробіть висновок про застосування такого методу електролізу.
Визначте масу або об’єм речовин, що виділяються на електродах (І=5А, t=5хвил.)
| Рівняння дисоціації: Процеси: (-) К (+) А(Си - мідний) Розрахунки: |
Висновки і місце для домашніх задач:

Оцінка___________ Дата____________ Підпис викладача___________
Дата публикования: 2014-11-18; Прочитано: 993 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
