 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Хімічний елемент —це сукупність атомів, що мають однаковий заряд ядра і, як наслідок, однаковий атомний номер
|
|
Атом — це електронейтральна частинка, яка складається з позитивно зарядженого ядра і негативно
заряджених електронів, що оточують його.
Хімічні властивості атомов залежать від заряду ядра і розподілу його електронів.
Електрони перебувають на певних енергетичних рівнях, їх стан умовно характеризується чотирма квантовими числами.
n — головне квантове число:
- Приймає значення натурального ряду чисел від 1 до
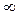 (n=1…7…)
(n=1…7…) - Характеризує:
– енергетичний стан електрона в атомі, тобто енергію електрона на певному енергетичному рівні.
– номер періоду елемента в періодичній системі Д.І.Менделєєва співпадає з числом енергетичних рівнів у атомі.
– визначає максимальне число електронів на енергетичному рівні: Nmax = 2n2 
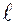 — Орбітальне квантове число:
— Орбітальне квантове число:
1. Набуває всіх числових значень від 0 до (n-1)
2. Характеризує:
– форму атомної електронної орбіталі (АО) (дивись табл. 3)
– енергетичний стан електрона на енергетичному підрівні у залежності від форми АО,
– кількість підрівнів на рівні (табл.4).
Таблиця 3. ЗНАЧЕННЯ ℓ і ФОРМА АО
Числові значення 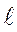
| Буквені позначення форми АО | Геометрична форма АО | |
| s | сферична |    
| |
| p | гантелеподібна |   
| |
| d | чотирьохпелюсткова |

| |
| f | шестипелюсткова | 
|
Зверніть увагу! В табл.4 - кількость підрівнів на рівні співпадає з номером рівня, тобто це є число значень орбітального
квантового числа 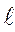 .
.
Так, перший рівень ( n=1) складається тільки з одиого підрівня (1s), тому що йому відповідає тільки одне значення
орбітального квантового числа 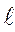 =0.
=0.
Другий енергетичний рівень (n=2) розщеплюється на 2 підрівні: 2s (ℓ=0) і 2p (ℓ =1).
Третій енергетичний рівень (n=3) розщеплюється на 3 підрівні: 3s (ℓ=0), 3p (ℓ =1) і 3d (ℓ =2).
Таблиця 4. ЗНАЧЕННЯ n,ℓ і КІЛЬКІСТЬ ПІДРІВНІВ В АТОМАХ
| n | Числові значення 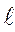
| Кількість підрівнів на рівні |
| 0,1 0,1,2 0,1,2,3 | 1(один підрівень, який характеризується орбітальним квантовим числом «нуль») 2(два підрівня, - перший підрівень характеризується орбітальним квантовим числом «нуль» - другий підрівень характеризується орбітальним квантовим числом «один») 3 підрівня (ℓ=0; ℓ=1; ℓ=2) 4 підрівня (ℓ=0; ℓ=1; ℓ=2; ℓ=3) |
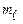 — магнітне квантове число
— магнітне квантове число
1. набуває всіх послідовних цілочислових значень від 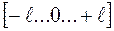
Дата публикования: 2014-11-18; Прочитано: 392 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
