 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Краткие теоретические сведения. К электрохимическим будем относить процессы, сопровождающиеся переносом заряда, образованием двойного электрического слоя (ДЭС) и идущие на поверхности
|
|
К электрохимическим будем относить процессы, сопровождающиеся переносом заряда, образованием двойного электрического слоя (ДЭС) и идущие на поверхности раздела фаз. Такой комплекс процессов, как правило, сопровождается взаимным превращением электрической энергии в химическую в результате протекания окислительно-восстановительных реакций.
Электрохимический потенциал возникает на поверхности раздела фаз электрод – раствор. Причиной образования электродного потенциала является появление на поверхности электрода двойного электрического слоя, который можно сравнить с плоским конденсатором, одной обкладкой которого служит заряженная поверхность металла, а другой – внешняя граница ДЭС. В простейшем случае двойной электрический слой состоит из слоя потенциалопределяющих ионов, расположенных непосредственно на поверхности электрода, и слоя противоионов, которые соединены с потенциалопределяющими ионами за счет сил электростатического взаимодействия.
Непосредственно измерить потенциал какой-либо системы не представляется возможным. Мы можем измерить только разность потенциалов или электродвижущую силу (ЭДС) гальванической системы, состоящей из пары электродов – электрохимической цепи. С другой стороны, потенциал электрода зависит от температуры и концентрации раствора. В связи с этим было введено понятие стандартного водородного электрода и шкалы стандартных электродных потенциалов. Потенциал стандартного водородного электрода условно принят равным нулю и относительно него считаются потенциалы всех возможных электродных систем, приведенные к единым условиям: температура 298 K и концентрация раствора 1 моль/кг (если речь идет о газовых электродных системах, то давление газа – 1 атм).
Зависимость потенциала электрода от состава раствора была выведена Нернстом для окислительно-восстановительного процесса, протекающего на поверхности электрода 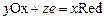 :
:
 ,
,
где  – электродный потенциал, В;
– электродный потенциал, В; 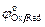 – стандартный электродный потенциал, В; R – универсальная газовая постоянная; Т – температура, K; z – число электронов, принимающих участие в электродном процессе; F – постоянная Фарадея;
– стандартный электродный потенциал, В; R – универсальная газовая постоянная; Т – температура, K; z – число электронов, принимающих участие в электродном процессе; F – постоянная Фарадея;  – активность окисленной формы элемента в растворе;
– активность окисленной формы элемента в растворе;  – активность восстановленной формы.
– активность восстановленной формы.
При схематической записи электрохимических систем, а также уравнений протекающих в них реакций необходимо соблюдать следующие основные правила. Для электродов (полуэлементов) вещества, находящиеся в растворе, указываются слева от вертикальной черты, справа указываются вещества, образующие другую фазу, или электродный материал, например,  . Если одна фаза содержит несколько веществ, то их символы разделяются запятыми.
. Если одна фаза содержит несколько веществ, то их символы разделяются запятыми.
Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме, например: Cu2+ + 2e = Cu0; 2H+ + 2 e = H2; Fe3+ + e = Fe2+.
Принять различать 4 типа электродных систем.
Электроды 1 рода образованы простым веществом (металлом или неметаллом), погруженным в раствор своей соли. Металлическому электроду Ме z +|Ме соответствует реакция Ме z + + ze = Me и потенциал электрода описывается уравнением:
 .
.
Примерами электрода первого рода могут быть медный электрод Cu2+|Cu (CuSO4|Cu), цинковый электрод Zn2+|Zn (ZnSO4|Zn) и др.
Неметаллическому электроду Az-|A соответствует электродная реакция A + ze = A z - и потенциал электрода описывается уравнением:
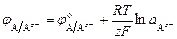 .
.
Потенциал электрода первого рода зависит от активности лишь одного сорта ионов.
Электроды 2 рода состоят из металла, покрытого слоем своей малорастворимой соли и погруженного в раствор, содержащий одноименные с этой солью анионы An−|MeAn, Me. Уравнение Нернста для электрода 2 рода записывается следующим образом:
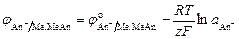 .
.
Примером электрода второго рода может служить хлорсеребряный электрод,  , потенциал которого зависит от содержания ионов Cl- в растворе. Хлорсеребряный электрод нередко используют в качестве электрода сравнения при потенциометрических измерениях. В этом случае приэлектродное пространство заполняют насыщенным раствором хлорида калия, что обеспечивает стабильность значения электродного потенциала.
, потенциал которого зависит от содержания ионов Cl- в растворе. Хлорсеребряный электрод нередко используют в качестве электрода сравнения при потенциометрических измерениях. В этом случае приэлектродное пространство заполняют насыщенным раствором хлорида калия, что обеспечивает стабильность значения электродного потенциала.
Газовые электроды состоят из инертного металла (Pt), контактирующего с газом и с раствором, содержащим одноименные с газом ионы. Самый известный пример газового электрода – водородный электрод: H+|H2, Pt. Для этого электрода реализуется реакция: H+ + e ® 1/2H2, для которой уравнение Нернста:
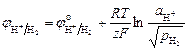 или
или  .
.
Окислительно-восстановительные электроды. Такая система состоит из компонентов, находящихся в растворе. В этом случае индикаторным электродом служит инертный металл (обычно платина или золото), который не принимает участия в реакции, а служит лишь передатчиком электронов между компонентами окислительно-восстановительной системы, поэтому только последние определяют величину потенциала электрода. Примером может служить платина, погруженная в раствор, содержащий Fe2+ и Fe3+. В этом случае на электроде протекает реакция Fe3+ + е = Fe2+, потенциал которой будет определяться уравнением:
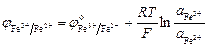 .
.
Два электрода, соединенных друг с другом посредством электролитического мостика или каким-либо другим проводником, представляют собой электрохимическую цепь. Для записи формул цепей существуют определенные правила. Слева располагается электрод, имеющий более отрицательный потенциал (анод), а справа – менее отрицательный (катод). На катоде идет процесс восстановления:  , на аноде идет процесс окисления:
, на аноде идет процесс окисления:  .
.
Растворы обоих электродов отделяются вертикальной пунктирной линией:  или двумя сплошными линиями, если между растворами находится солевой мостик
или двумя сплошными линиями, если между растворами находится солевой мостик 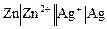 .
.
Электрической характеристикой электрохимической цепи является электродвижущая сила. ЭДС гальванического элемента определяется по формуле:
Е = jК – jА или Е = jox - jred,
где jК и jА – потенциалы катода и анода; jox – электрохимический потенциал «окислителя», более положительного электрода, jred – электрохимический потенциал «восстановителя», более отрицательного электрода.
Электрохимическая цепь может быть составлена из разных электродов или из одинаковых электродов. В последнем случае, так как потенциал электрода зависит от концентрации, ЭДС гальванического элемента, составленных из однотипных электродов (один и тот же металл в растворе одной и той же соли) с разными концентрациями растворов, будет отличен от нуля. Такой гальванический элемент называется концентрационным. Анодом в нем является электрод с меньшей концентрацией потенциалопределяющих ионов.
Разность электрохимических потенциалов определяет направление протекания процесса:
D G = − zFE,
где D G – энергия Гиббса электрохимической реакции, z – число электронов, принимающих участие в окислительно-восстановительном процессе, F – число Фарадея, Е – разность потенциалов.
Направление электрохимического процесса (в стандартных условиях, при единичных активностях компонентов) можно оценить используя значения стандартных электрохимических потенциалов.
Группа методов анализа, основанная на измерении ЭДС электрохимических систем получила название потенциометрический анализ или потенциометрия. Существуют два основных варианта проведения потенциометрического анализа растворов: метод прямой потенциометрии и потенциометрическое титрование.
Метод прямой потенциометрии, помимо установления концентрации определяемого вещества в растворе, позволяет определить такие важные физико-химические величины, как значение стандартного электродного потенциала, средний ионный коэффициент активности электролита, константу диссоциации слабого электролита, растворимость малорастворимого соединения и т.д. Особенно важно, что потенциометрические методы можно применять для изучения процессов в неводных средах. В настоящее время все большее применение получают мембранные электроды, которые представляют собой тонкую мембрану, способную обмениваться с раствором ионами. Вследствие такого обмена на границе «мембрана – раствор» устанавливается потенциал, зависящий от концентрации обмениваемых ионов в растворе.
В качестве электродов сравнения при потенциометрических определениях наиболее часто используют хлорсеребряный или каломельный электроды. Электроды сравнения, если это допустимо, погружают непосредственно в исследуемый раствор или соединяют с ним посредством электролитического мостика – стеклянной U-образной трубки, наполненной электролитом (чаще всего хлоридом или нитратом калия).
Контрольные вопросы
1. Какие процессы относят к электрохимическим?
2. Что такое двойной электрический слой?
3. Какими способами может образовываться ДЭС?
4. Что такое стандартный водородный электрод?
5. От каких параметров системы зависит величина электрохимического потенциала?
6. Каким уравнением описывается зависимость электрохимического потенциала от параметров состояния электрохимической системы?
7. Что такое электрод 1 рода? Как выглядит уравнение Нернста для электрода 1 рода применительно к свинцовому электроду?
8. Что такое электрод 2 рода? Уравнение Нернста для хлорсеребряного электрода.
9. Приведите определение газового электрода.
10. Составьте уравнение Нернста для окислительно-восстановительного электрода?
11. Перечислите правила записи формулы электрода.
12. Правила записи формулы гальванического элемента.
13. Что такое катод и анод?
15. Как вычисляется ЭДС гальванического элемента?
16. Как связаны ЭДС и энергия Гиббса?
17. Какой электрод используется в потенциометрии в качестве электрода сравнения?
Дата публикования: 2014-11-18; Прочитано: 427 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
